2. 上海市水域环境生态上海高校工程研究中心 上海 201306;
3. 陶氏化学(中国)投资有限公司 上海 201203;
4. 上海市奉贤区水产技术推广站 上海 201499
2. Research and Engineering Center on Aquatic Environment Ecosystem, Shanghai 201306;
3. Dow Chemical (China) Investment Company Limited, Shanghai 201203;
4. Fengxian Fisheries Technology Extension Station, Shanghai 201499
凡纳滨对虾(Litopenaeus vannamei)又称南美白对虾,是我国对虾养殖的主要品种之一(黄永春等, 2010)。随着凡纳滨对虾集约化养殖的迅速发展,养殖水质恶化及对虾种质退化等问题给对虾养殖带来的风险不断加大。氨氮和亚硝酸氮是诱发对虾暴发疾病的主要因素,也是造成生态环境污染的主要因子之一(王年斌等, 2004)。
目前,改善对虾水质的生态养殖模式主要有混养(梁志辉等, 2007)、种植浮床植物(戴习林等, 2012)以及循环水养殖(Zhang et al, 2011)等。其中,以生物滤器为核心处理单位的循环水养殖主要利用滤料表面形成的生物膜去除水体中氨氮和亚硝酸氮,是改善水质最为有效的方法之一(黄滨等, 2016)。生物膜由微生物附着于不同载体而形成,其形成方式主要有两种,一是根据用途采用已筛选出具有特殊功能的微生物进行挂膜培养,二是利用养殖水体中土著微生物自然挂膜。后者因其操作简单、成本较低而被广泛应用。
生物膜中微生物种类的组成和优势功能菌的比例,对于研究生物膜功能机理及对有害污染物的降解转化具有重要意义,而且对构建不同条件下循环水养殖系统具有指导意义。许多学者对于循环水养殖系统中生物膜上微生物多样性进行了报道。Schreier等(2010)研究了循环水养殖系统中生物滤膜上的微生物多样性;Wold等(2014)研究了鳕鱼(Gadus morhua)海水循环水养殖系统生物膜微生物多样性;姚延丹等(2011)对复合池塘循环水养殖系统内微生物群落结构进行了分析;李秋芬等(2011)通过PCR-DGGE法分析了循环水养殖系统生物滤池细菌群落的结构变化;张海耿等(2011)研究了循环水养殖系统生物载体上微生物群落多样性变化。然而,多数研究仅对生物滤器内某一特定部位或进行混合取样,而生物滤器不同部位由于水流、溶解氧、有机物负荷等的不同,有可能存在较大差异,但这方面的研究尚未见报道。
本研究通过16S rRNA基因高通量测序法,检测分析凡纳滨对虾养殖过程中挂膜式生物滤器内(以下简称生物滤器)的微生物多样性,并对滤器内不同部位间微生物多样性进行对比分析,以期为深入了解生物滤器的作用机理及对挂膜式生物滤器的构建和改进提供理论依据。
1 材料与方法 1.1 实验塘基本情况实验于2015年4月1日–6月10日在上海奉贤区某养殖基地进行,凡纳滨对虾为大棚土塘养殖。养殖池水深为1.4 m,养殖水面约0.43 hm2,配有4台叶轮式增氧机(每天开启14 h),另配备20个全天开启的自沉式底部微孔曝气盘,投放苗种约50万尾、斑点叉尾鮰(Ietalurus punetaus)20尾,配备外置挂膜式生物滤器以实现循环水养殖(图 1)。养殖过程中未添加新水和换水,早晚各投喂饲料1次,养殖结束后收获成虾体长和体重分别为(9.81± 0.17) cm/尾和(5.43±0.25) g/尾。实验期间,实验塘水温和pH变化范围分别为25.3–33.8℃和7.81–8.61,主要营养盐指标总氮、总磷和高锰酸盐指数变化范围分别为3.09–4.15 mg/L、0.70–1.06 mg/L和6.34–8.33 mg/L。

|
图 1 凡纳滨对虾循环水养殖挂膜式生物滤器水处理系统模式 Figure 1 Technology flow chart of the recirculating aquaculture system for L. vannamei |
生物滤器为1.4 m×1.4 m×2 m的钢骨架结构,底部设0.2 m高的收集盘,滤器内部挂52根1 m×1.8 m的塑料骨架,每个骨架上搭1层1 m×3.6 m纳米纤维膜,自然披挂于骨架的左右两侧。通过水泵(功率为1.8 kW)将养殖池塘水抽至滤膜系统顶部,经顶部布水管均匀分布到各层纳米纤维材料的表面,汇入收集盘后经出水口排入养殖塘。生物滤器4月25日开启,至养殖生产结束时关闭。
1.2 样品采集与处理 1.2.1 样品采集养殖结束后,关闭生物滤器,打开装置外壳,按图 1所示采集不同部位微生物样品。上部采样位置距挂膜顶层20 cm,下部采样位置距挂膜底部20 cm,上下部均采集挂膜外侧和内侧微生物,另采集收集盘内沉积物,采集样品均保存于10 ml灭菌离心管内,–80℃冷藏待处理。各部位样品编号:上部膜内侧(SN),上部膜外侧(SW),下部膜内侧(XN),下部膜外侧(XW),收集盘内沉积物(D)。
1.2.2 样品DNA提取无菌条件下称取0.2 g样本,放入5 ml灭菌塑料离心管中,加入1 ml SLX-Mlus Buffer缓冲液和100 μl DS Buffer缓冲液,70℃孵育10 min,室温、3000 r/min离心3 min,吸取800 μl上清液至2 ml离心管中。加入270 μl P2 Buffer,涡旋混匀,冰上孵育5 min,4℃、12000 r/min离心5 min,转移上清液至1.5 ml离心管中,加入0.7倍体积的异丙醇,混匀,–20℃下放置1 h,然后4℃、12000 r/min离心5 min。采用试剂盒(E.Z.N.A.Soil DNA Kit)提取该微生物基因组DNA,分别用Qubit 2.0和琼脂糖凝胶检测DNA浓度。
1.2.3 16S rRNA基因的PCR扩增PCR扩增采用环境微生物16S rRNA通用引物:上游引物341F5′(5′-CCCTACACGACGCTCTTCCGATCTG-3′)和下游引物805R3′(3′-GACTGGAGTTCCTTGGCA CCCGAGAATTCCA-5′),用于PCR扩增的16S rDNA片段由上海生物工程技术服务有限公司合成。扩增反应体系为50 μl:10×PCR缓冲液5 μl,上下游引物各0.5 μl (50 μmol/L),0.5 μl dNTP (10 mmol/L),0.5 μl Taq DNA聚合酶(5 U/μl),模板10 ng,加双蒸水定容至50 μl。反应程序:94℃预变性3 min;94℃变性30 s,45℃退火20 s,65℃延伸30 s,5个循环;94℃变性20 s,55℃退火20 s,72℃延伸30 s,共20个循环;72℃延伸5 min。PCR结束后,用1.5%琼脂糖凝胶电泳检测结果,并在目的条带处用SanPrep柱式DNA胶回收试剂盒割胶回收。
1.2.4 16S rRNA基因测序16S rRNA基因测序交由上海生物工程技术服务有限公司完成,将所测基因序列通过Blast (http://www.ncbi.nlm.nib.gov/blast/blast.cgi)在GenBank中进行相似序列搜索,根据最相似序列确定其系统发育地位。
1.3 数据分析将多条序列按其序列间的距离进行聚类,然后以序列之间的相似性作为域值(0.97) 分成操作分类单元OTU。根据OTU数目进行Alpha多样性指数计算,指数包括香农指数(Shannon Index)、ACE指数、Chao1指数、Coverage和Simpson等。Chao1指数和ACE指数均由Chao等(2002)提出,用来估计群落中含有的OTU数目,是生态学中估计物种总数的常用指数。Coverage是指各样品文库的覆盖率,其数值越高,样本中序列没有被测出的概率越低,该指数实际反映了本次测序结果是否代表样本的真实情况(Li et al, 2015)。Alpha多样分析采用mothur (Schloss et al, 2011),相关网址:http:/www.mothur.org/。
常规数据处理及作图使用Excel软件统计分析;非参数检验、方差分析(One-way ANOVA)及NMDS作图采用SPSS 19.0进行;样本距离heatmap图所用软件为R语言程序包“pheatmap”。
2 结果 2.1 微生物物种组成对生物滤器内5个不同部位微生物进行测序分析。在门水平共鉴定出10个主要类群(图 2-a),包括变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、硝化螺旋菌门(Nitrospirae)、浮霉菌门(Planctomycetes)、衣原体门(Chlamydiae)、芽单胞菌门(Gemmatimonadetes)、绿弯菌门(Chloroflexi)、疣微菌门(Verrucomicrobia)和蓝藻门(Cyanobacteria)。变形菌门、拟杆菌门和厚壁菌门在不同部位均为主要优势门类,其中,变形菌门为绝对优势门类。挂膜上所检测出硝化螺旋菌门比例(平均为4.33%)显著高于收集盘内比例(0.33%),非参数检验表明,存在极显著性差异(P < 0.01);上部膜内(5.53%)、上部膜外(4.36%)和下部膜内(4.41%)三者之间无显著性差异,但比例均高于下部膜外(3.03%),非参数检验表明,存在显著性差异(P < 0.05)。收集盘内浮霉菌门和疣微菌门所占比例均高于其在挂膜上的比例。其他门类相对比例较小,不同部位间差异不显著。在属水平上,5个不同部位共鉴定出743种微生物,种类数由多至少依次为D > SN > SW > XN > XW(图 2-b)。

|
图 2 生物滤器内不同部位微生物组成 Figure 2 Dominant bacterial community of the biological filter a:门类水平;b:属水平 a: Phylum level, b: Genus level |
将生物滤器5个不同部位中均存在且丰度比例大于0.1%的微生物种类(属水平)定为优势属,共鉴定出41个优势属(表 1)。地杆菌属(Pedobacter)为绝对优势,丰度比例均在10%以上;短小盒菌属(Parvularcula)为次优势属,在SN、SW和XN部位丰度比例在10%以上,SW和D中比例较小;第三优势属为硝化螺旋菌属(Nitrospira),各挂膜不同部位含量均较高(平均值为4.31%),收集盘内较低(0.28%)。
|
|
表 1 不同部位微生物优势属丰度比例(%) Table 1 Relative abundance of dominant microbial genus in different positions (%) |
根据微生物种属的功能,可将系统内优势种属分为4类。第1类是可直接参与硝化或反硝化作用的硝化类群(Orso et al, 1994; Yin et al, 2009; Purkhold et al, 2000),共10种,包括亚硝化单胞菌(Nitrosomonas)、芽殖小小梨形菌属(Blastopirellula)及亚硝化球菌属(Nitrosococcus) 3种氨氧化菌(AOB),以及硝化螺旋菌属(Nitrospira)、黄色单胞菌科(Silanimonas)、固氮弧菌属(Azoarcus)、土微菌属(Pedomicrobium)、副球菌属(Paracoccus)、埃希氏-志贺菌属(Escherichia-Shigella)和红螺菌科(Defluviicoccus) 7种硝化菌(NOB);第2类是可利用有机物参与氮代谢循环的类群(冯丽娟等, 2011; 唐美珍等, 2014; 马溪曼等, 2015),共8种,包括假单胞菌属(Pseudomonas)、金色单胞菌属(Chryseolinea)、小红卵菌属(Rhodovulum)、小梨形菌属(Pirellula)、维斯氏菌属(Weissella)、生丝微菌属(Hyphomicrobium)、线状微球菌属(Filomicrobium)和脱硫叶菌属(Desulfobulbus);第3类主要为具有抵抗重金属及降解芳香类有机污染物的类群(袁军等, 2008; Arun et al, 2009),共3种,分别为短小盒菌属(Parvularcula)、赤杆菌科(Altererythrobacter)和新鞘氨醇杆菌属(Novosphingobium);第4类为其他污水处理系统或生物膜反应器中常见种属(Zhou et al, 2012),如地杆菌属(Pedobacter)、玫瑰变色菌(Roseovarius)等。
2.3 α多样性分析通过高通量测序技术,根据barcode标签对序列进行拆分,对所测序列进行冗余处理,获得相似度97%以上的序列,并将其聚类为用于分析的OTU单元。由于样品间存在一定的差异以及测序技术本身的缺陷,每个样品所测出的有效序列数存在差异(表 2)。下部膜外OTU数目最少,非参数检验表明,其与其他部位间存在显著性差异(P < 0.05)。ACE指数及Chao1指数受OTU数目影响也出现类似结果,下部膜外多样性指数明显低于其他部位(P < 0.05)。5个不同部位之间Shannon指数和Simpson值无显著性差异,根据生物多样性阈值的分级评价标准(蔡立哲等, 2002)可知,Shannon指数均在处于Ⅴ级,微生物物种多样性丰富。
|
|
表 2 不同部位微生物多样性指数 Table 2 The diversity index for bacterial community in different samples |
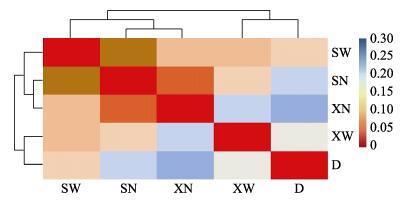
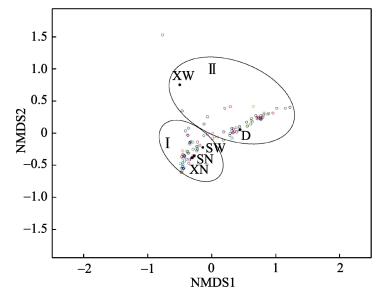
根据5个不同部位间所测序列的相似程度及相对丰度,对各样品进行相似性聚类热图分析(图 3),并根据属水平差异进行非多维尺度分析(NMDS),二者分析结果较为类似。相似性聚类热图分析中,颜色深浅用于判断样品两两之间的相似程度,颜色越红越相近,越蓝则相差越大。由聚类结果可知,上部膜内(SN)、下部膜内(XN)以及上部膜外(SW)可以聚为一支,下部膜外(XW)与收集盘内(D)微生物可以聚为一支。相似性分析显示,不同样品间微生物组成存在极显著差异(P < 0.01)。由图 3可知,SN与XN组间微生物相似性最高,SN与SW之间的相似性次之,XN与D内微生物相似性最低。NMDS的分析结果见图 4,其压力系数stress=0.1,排序结果较好,分析结果与聚类分析结果较为类似。
|
图 3 不同部位间相似性聚类热图 Figure 3 Heatmap and cluster analysis of microorganism communities in five sampling positions |
|
图 4 不同部位间NMDS分析 Figure 4 NMDS of microorganism communities in five sampling positions on genus level |
变形菌门作为自然界最为丰富的一个门类,在众多环境中均为绝对优势种。本研究中,变形菌门为绝对优势门类,平均比例为40%,挂膜各部位间不存在显著性差异,但均显著高于收集盘中的33.18%,这与多数研究结果较为类似。张海耿等(2011)对循环水养殖系统中生物膜载体上微生物种类组成进行研究发现,变形菌门比例为51.52%,并认为β变形菌是废水处理系统中除氮的主要类群;郑林雪等(2015)对缺氧/好氧膜生物反应器中好氧池和厌氧池中微生物多样性研究发现,变形菌门在好氧池和厌氧池中的比例分别为37.04%和27.91%,并认为溶解氧的差异是变形菌门比例不同的主要原因。本研究中,变形菌门比例较高,高比例变形菌门对于系统脱氮具有重要作用(张海耿等, 2011),溶氧和有机物含量的不同是不同部位间变形菌门比例产生差异的主要原因(郑林雪等, 2015)。系统内水流从生物滤器顶部进入、分散并流过挂膜表面,与膜上微生物接触后,水中有机物被分解,过剩的营养物质被迅速去除,溶解氧含量迅速降低,水流汇入收集盘时,溶解氧和有机物含量已与进入系统时存在较大差异,因此,收集盘内变形菌门比例较小。
硝化螺旋菌是参与氮代谢循环的重要微生物,也是生物系统内部将亚硝酸氮和氨氮氧化的重要微生物,是主要目的功能菌,其比例的多少直接影响生物膜系统对于亚硝酸氮和氨氮的去除能力。研究表明,在自然环境中硝化螺旋菌门为劣势种类,在水体及土壤中含量均不高(Gibbons et al, 2015),在养殖水体中硝化螺旋菌门的比例也较小(李敬源等, 2012),在不同废水处理系统中硝化螺旋菌门比例存在一定差异。张楠等(2015)用A/O生物膜法强化处理石化废水中微生物群落多样性表明,硝化螺旋菌门比例低于1%,氨氮去除率可达93%–96%左右,去除率较高;曾薇等(2015)研究污水处理系统中硝化螺旋菌菌群结构变化时发现,4种不同工艺污水处理系统中硝化螺旋菌门比例在1%–7%之间,氨氮去除率可达70%以上,可以看出硝化螺旋菌门比例在较低情况下即可达到很好的除氨氮效果。本研究中,硝化螺旋菌门所占比例较高(挂膜上平均比例为4.33%),挂膜各部位与收集盘内存在极显著差异(P < 0.01),较高的硝化螺旋菌门比例是本实验能有效去除氨氮和亚硝酸氮的原因。不同部位间硝化螺旋菌门的差异与多种原因有关,众多研究表明,硝化细菌对于不同工艺及环境非常敏感,受各种因素,例如溶解氧、温度、水力停留时间及各种水体中抑制剂等因素影响较大(Geets et al, 2006; Blackbume et al, 2008; Bollmann et al, 2011)。本研究中,生物滤器为挂膜式,相邻膜之间存在空隙,透氧能力较好,这符合硝化螺旋菌门好氧生长的习性;其次,水流经生物滤器顶部流经膜表面时溶解氧和有机物较为丰富,利于微生物的大量繁殖;再者,由于收集盘内水体溶解氧和有机物含量降低,且没有太多微生物附着点,不利于微生物的繁殖和积累,因而,收集盘内硝化螺旋菌门明显少于其他部位。
3.2 主要优势种的变化所测样品中共鉴定出41种优势属,其中,以地杆菌属和短小盒菌属为主要优势属,丰度比例均在10%以上,二者均为生物滤器内常见微生物种类,其中,短小盒菌属具极强的高温抗逆性,而且有一定抗重金属的能力,有望成为在恶劣环境下进行生态修复的重要种群(Arun et al, 2009)。本研究中,硝化螺旋菌属为第三优势属,相对丰度比例较高,是硝化作用的主要类群(张海耿等, 2011)。AOB及NOB是影响生物滤器去除氨氮和亚硝酸氮的主要微生物类群,曾薇等(2015)研究发现,处理系统内的AOB丰度比例0.3%、NOB达5.26%时,即可达到很好的氨氮除去效果,并认为AOB的含量决定了系统硝化的效果。张楠等(2015)研究发现,AOB含量为0.16%、NOB含量为1.12%时,系统的总氮去除效率可达到21%。本研究中,微生物优势属中共鉴定出3种AOB微生物,挂膜上丰度加和比例为1.35%–1.87%;7种NOB微生物在挂膜上丰度加和比例为5.76%–8.52%,AOB和NOB丰度比例较高,较高的AOB和NOB含量是本实验具有较好的除氨氮和亚硝酸氮效果的主要原因。本研究中,还发现一定比例的可同步进行硝化反硝化作用的微生物包括土微菌属、副球菌属和红螺菌科(杨航等, 2008; 孙雪等, 2014),硝化反硝化微生物的存在大大缩短了生物滤器除氮时间,提高了除氮效率(黎乾等, 2011)。
3.3 多样性分析下部膜外OTU数目显著低于其他部位,其他部位间不存在显著性差异,即在同样称取0.2 g样品中,下部膜外所含有效微生物量较其他部位少。由于挂膜方式为双层挂膜,每两层之间由一塑料支架支撑,多层塑料支架紧密排列,膜内侧由塑料支架分开,而膜外侧则与相邻膜紧密接触。挂膜上部由于水体的冲击力较大,外膜间并未产生粘黏性接触,而随着水体的冲击力减小,下部膜外产生黏贴。大面积外膜黏贴导致膜表面溶解氧降低和水流受阻,同时也导致微生物附着面积减少,因此,下部膜外有效微生物含量较其他部位少。ACE指数及Chao1指数受OTU数目影响也出现类似结果。5个不同部位间Shannon指数不存在显著性差异,指数值均处于Ⅴ级,微生物物种多样性丰富,表明生物滤器内微生态系统稳定,对水中营养盐的变化能起到很好的缓冲作用。
4 结论本研究中,挂膜上AOB细菌比例和NOB细菌比例较高,生物滤器具有较好的去除氨氮和亚硝酸氮的效果。生物滤器内生物多样性较高,对稳定滤器的水处理效果具有重要作用。综合不同部位间功能微生物比例的差异可知,收集盘基本不具有硝化能力,因此,需定时清理收集盘内沉积物,以免消耗水体中大量溶解氧而产生厌氧反硝化现象。生物滤器挂膜下部外侧有效微生物含量较低,对水体氨氮和亚硝酸氮的去除能力较弱,硝化和反硝化作用主要在生物滤器上部进行。设计挂膜式生物滤器时,应合理配置挂膜数量,科学设计挂膜长度以提高生物滤器的净化效率。
| Arun AB, Chen WM, Lai WA, et al. Parvularcula lutaonensis sp. nov., a moderately thermotolerant marine bacterium isolated from a coastal hot spring. International Journal of Systematic and Evolutionary Microbiology, 2009, 59(5): 998-1001 DOI:10.1099/ijs.0.004481-0 | |
| Blackburne R, Yuan ZG, Keller J. Partial nitrification to nitrite using low dissolved oxygen concentration as the main selection factor. Biodegradation, 2008, 19(2): 303-312 DOI:10.1007/s10532-007-9136-4 | |
| Bollmann A, French E, Laanbroek HJ. Chapter three-Isolation, cultivation, and characterization of ammonia-oxidizing bacteria and archaea adapted to low ammonium concentrations. Methods in Enzymology, 2011, 486: 55-88 DOI:10.1016/B978-0-12-381294-0.00003-1 | |
| Cai LZ, Ma L, Gao Y, et al. Analysis on assessing criterion for polluted situation using species diversity index of marine macrofauna. Journal of Xiamen University (Natural Science), 2002, 41(5): 641-646 [蔡立哲, 马立, 高阳, 等. 海洋底栖动物多样性指数污染程度评价标准的分析. 厦门大学学报(自然科学版), 2002, 41(5): 641-646] | |
| Chao A, Bunge J. Estimating the number of species in a stochastic abundance model. Biometrics, 2002, 58(3): 531-539 DOI:10.1111/j.0006-341X.2002.00531.x | |
| Dai XL, Guo Y, Qian HR, et al. The purification effect of three vegetables and different cultivation on aquaculture water from shrimp pond. Journal of Shanghai Ocean University, 2012, 21(5): 777-783 [戴习林, 郭印, 钱辉仁, 等. 3种蔬菜及浮植方式对虾池水体的净化效果. 上海海洋大学学报, 2012, 21(5): 777-783] | |
| Feng LJ, Zhu L, Xu J, et al. Enhanced denitrification in the biofilm process remedying polluted water source via step-feeding. Acta Scientiae Circumstantiae, 2011, 31(12): 2595-2600 [冯丽娟, 朱亮, 徐京, 等. 分段配水强化受污染水源水生物膜修复工艺脱氮性能研究. 环境科学学报, 2011, 31(12): 2595-2600] | |
| Geets J, Boon N, Verstraete W. Strategies of aerobic ammonia-oxidizing bacteria for coping with nutrient and oxygen fluctuations. FEMS Microbiology Ecology, 2006, 58(1): 1-13 DOI:10.1111/fem.2006.58.issue-1 | |
| Gibbons SM, Gilbert JA. Microbial diversity—Exploration of natural ecosystems and microbiomes. Current Opinion in Genetics & Development, 2015, 35: 66-72 | |
| Huang B, Ma T, Liu BL, et al. Effects of ozone concentration on the activity of biofilm and its effectiveness of purification in recirculating aquaculture systems. Progress in Fishery Sciences, 2016, 37(3): 143-147 DOI:10.11758/yykxjz.20150309003 [黄滨, 马腾, 刘宝良, 等. 不同浓度臭氧对循环水养殖系统生物膜活性及其净化效能的影响. 渔业科学进展, 2016, 37(3): 143-147] | |
| Huang YC, Ai HS, Yin ZX, et al. Studies on WSSV resistant and immune characteristics of the 4th generation selective breeding families for resistance to the white spot syndrome virus(WSSV) of Litopenaeus vannamei. Journal of Fisheries of China, 2010, 34(10): 1549-1558 [黄永春, 艾华水, 殷志新, 等. 第四代凡纳滨对虾抗WSSV选育家系的抗病及免疫特性研究. 水产学报, 2010, 34(10): 1549-1558] | |
| Li JY, Lin WT, Luo JF, et al. Community structure of microbes involved in nitrification and denitrification in typical shrimp-farming water. Acta Microbiologica Sinica, 2012, 52(4): 478-488 [李敬源, 林炜铁, 罗剑飞, 等. 典型对虾养殖水体中参与硝化与反硝化过程的微生物群落结构. 微生物学报, 2012, 52(4): 478-488] | |
| Li Q, Wu SW, Wu WX, et al. Effect of injected leachate C/N ratio on the denitrification of a bioreactor filled with landfilled refuse. Environmental Science, 2011, 32(11): 3387-3393 [黎乾, 吴松维, 吴伟祥, 等. 回灌渗滤液C/N对填埋垃圾生物反应器反硝化特性的影响. 环境科学, 2011, 32(11): 3387-3393] | |
| Li QF, Fu XJ, Zhang Y, et al. PCR-DGGE analysis of bacterial communities in bio-filters of re-circulating mariculture system. Journal of Fisheries of China., 2011, 35(4): 579-586 [李秋芬, 傅雪军, 张艳, 等. 循环水养殖系统生物滤池细菌群落的PCR-DGGE分析. 水产学报, 2011, 35(4): 579-586] | |
| Li Y, Chen L, Wen H. Changes in the composition and diversity of bacterial communities 13 years after soil reclamation of abandoned mine land in eastern China. Ecological Research, 2015, 30(2): 357-366 DOI:10.1007/s11284-014-1230-6 | |
| Liang ZH, Wang ZC, Yang JL, et al. Polyculture of crab Scyllaserrata megalops with white leg shrimp Litopenaeus vannamei in ponds. Fisheries Science, 2007, 26(11): 606-609 DOI:10.3969/j.issn.1003-1111.2007.11.005 [梁志辉, 王志成, 杨家林, 等. 锯缘青蟹大眼幼体与凡纳滨对虾混养试验. 水产科学, 2007, 26(11): 606-609] | |
| Ma XM, Lu YY, Xie ZQ, et al. Effects of microorganisms related to carbon and nitrogen metabolisms on microbial structure in solid waste composting. Environmental Engineering, 2015, 33(12): 95-99 [马溪曼, 陆彦宇, 谢志全, 等. 添加碳氮代谢相关微生物对堆肥过程中菌群结构的影响. 环境工程, 2015, 33(12): 95-99] | |
| Orso S, Gouy M, Navarro E, et al. Molecular phylogenetic analysis of Nitrobacter spp. International Journal of Systematic and Evolutionary Microbiology, 1994, 44(1): 83-86 | |
| Purkhold U, Pommerening-Röser A, Juretschko S, et al. Phylogeny of all recognized species of ammonia oxidizers based on comparative 16S rRNA and amoA sequence analysis: Implications for molecular diversity surveys. Applied and Environmental Microbiology, 2000, 66(12): 5368-5382 DOI:10.1128/AEM.66.12.5368-5382.2000 | |
| Schloss PD, Gevers D, Westcott SL. Reducing the effects of PCR amplification and sequencing artifacts on 16S rRNA-based studies. PLoS One, 2011, 6(12): e27310 DOI:10.1371/journal.pone.0027310 | |
| Schreier HJ, Mirzoyan N, Saito K. Microbial diversity of biological filters in recirculating aquaculture systems. Current Opinion in Biotechnology, 2010, 21(3): 318-325 DOI:10.1016/j.copbio.2010.03.011 | |
| Sun X, Zhu WJ, Wang L, et al. Review on the main microorganisms and their metabolic mechanisms in enhanced biological phosphorus removal (EBPR) systems. Chinese Journal of Applied Ecology, 2014, 25(3): 892-902 [孙雪, 朱为静, 王亮, 等. 强化生物除磷系统主要微生物及其代谢机理研究进展. 应用生态学报, 2014, 25(3): 892-902] | |
| Tang MZ, Yao SM, Zhang FF, et al. Pollutants removal by Pseudomonas flava WD-3 and Monod model simulation in constructed wetland. Acta Scientiae Circumstantiae, 2014, 34(12): 3050-3056 [唐美珍, 姚淑敏, 张凤凤, 等. Pseudomonas flava WD-3对人工湿地污染物的去除及Monod模型模拟. 环境科学学报, 2014, 34(12): 3050-3056] | |
| Wang NB, Han JB, Zhou ZC, et al. Environmental factors in shrimp culture ponds related with diseases outbreaks. Fisheries Science, 2004, 23(12): 5-8 DOI:10.3969/j.issn.1003-1111.2004.12.002 [王年斌, 韩家波, 周遵春, 等. 虾池水环境因子与虾病爆发的相关性分析. 水产科学, 2004, 23(12): 5-8] | |
| Wold PA, Holan AB, Øie G, et al. Effects of membrane filtration on bacterial number and microbial diversity in marine recirculating aquaculture system (RAS) for Atlantic cod (Gadus morhua L.) production. Aquaculture, 2014, 422-423(Suppl)): 69-77 | |
| Yang H, Huang J, Liu B. Advances in research of heterotrophic nitrification-Aerobic denitrification strain Paracoccus pantotrophus ATCC 35512. Chinese Journal of Applied and Environmental Biology, 2008, 14(4): 585-592 [杨航, 黄钧, 刘博. 异养硝化-好氧反硝化菌Paracoccus pantotrophus ATCC 35512的研究进展. 应用与环境生物学报, 2008, 14(4): 585-592] | |
| Yao YD, Li G, Tao L, et al. Analysis of microbial community structure in an integrated pond recirculating aquaculture system. Journal of Fishery Sciences of China, 2011, 18(2): 407-415 [姚延丹, 李谷, 陶玲, 等. 复合池塘循环水养殖系统微生物群落结构分析. 中国水产科学, 2011, 18(2): 407-415] | |
| Yin J, Xu WF. Ammonia biofiltration and community analysis of ammonia-oxidizing bacteria in biofilters. Bioresource Technology, 2009, 100(17): 3869-3876 DOI:10.1016/j.biortech.2009.03.021 | |
| Yuan J, Lai QL, Zheng TL, et al. Polycyclic aromatic hydrocarbon-degrading bacterium Novosphingobium sp.H25 isolated from deep sea and its degrading genes. Acta Microbiologica Sinica, 2008, 48(9): 1208-1213 [袁军, 赖其良, 郑天凌, 等. 深海多环芳烃降解菌新鞘氨醇杆菌H25的降解特性及降解基因. 微生物学报, 2008, 48(9): 1208-1213] | |
| Zeng W, Zhang LM, Wang AQ, et al. Community structures and population dynamics of nitrifying bacteria in activated sludges of wastewater treatment plants. China Environmental Science, 2015, 35(11): 3257-3265 DOI:10.3969/j.issn.1000-6923.2015.11.008 [曾薇, 张丽敏, 王安其, 等. 污水处理系统中硝化菌的菌群结构和动态变化. 中国环境科学, 2015, 35(11): 3257-3265] | |
| Zhang HG, Ma SS, Li QF, et al. Analysis of the changes of microbial community structure on bio-carrier of recirculating aquaculture systems(RAS). Environmental Science, 2011, 32(1): 231-239 [张海耿, 马绍赛, 李秋芬, 等. 循环水养殖系统(RAS)生物载体上微生物群落结构变化分析. 环境科学, 2011, 32(1): 231-239] | |
| Zhang N, Chu LB, Ding PY, et al. Enhanced treatment of petrochemical wastewater by using A/O biofilm reactor and analysis of biofilm community. China Environmental Science, 2015, 35(1): 80-86 [张楠, 初里冰, 丁鹏元, 等. A/O生物膜法强化处理石化废水及生物膜种群结构研究. 中国环境科学, 2015, 35(1): 80-86] | |
| Zhang SY, Li G, Wu HB, et al. An integrated recirculating aquaculture system (RAS) for land-based fish farming: The effects on water quality and fish production. Aquaculture Engineering, 2011, 45(3): 93-102 DOI:10.1016/j.aquaeng.2011.08.001 | |
| Zheng LX, Li J, Ren JZ, et al. Analysis of bacterial community composition by 16S rDNA clone library sampling from anoxic-aerobic membrane bioreactor process. Chinese Journal of Environmental Engineering, 2015, 9(5): 2503-2509 DOI:10.12030/j.cjee.20150576 [郑林雪, 李军, 任金柱, 等. 16S rDNA克隆文库解析AO-MBR系统中细菌种群多样性. 环境工程学报, 2015, 9(5): 2503-2509] | |
| Zhou ZC, Jiang F, Wang SF, et al. Pedobacter arcticus sp. nov., a facultative psychrophile isolated from Arctic soil, and emended descriptions of the genus Pedobacter, Pedobacter heparinus, Pedobacter daechungensis, Pedobacter terricola, Pedobacter glucosidilyticus and Pedobacter lentus. International Journal of Systematic & Evolutionary Microbiology, 2012, 62(8): 1963-1969 |



