2. 农业部海洋渔业可持续发展重点实验室 中国水产科学研究院黄海水产研究所 青岛 266071;
3. 青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室 青岛 266071;
4. 青岛瑞滋海珍品发展有限公司 青岛 266400
2. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071;
3. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071;
4. Qingdao Ruizi Seafood Development Co, Ltd, Qingdao 266400
刺参(Apostichopus japonicus)是典型的温带水产动物种类。在自然海域中,刺参具有夏季高温期(水温升高到22–26℃后)夏眠和冬季低温期(水温低于3℃后)冬蛰的生理习性(王印庚等, 2014)。于东祥等(1999)研究表明,刺参适宜生长的水温范围为8–17℃;陈勇等(2007)研究表明,刺参最适宜生长的水温范围为12–18℃。Yang等(2005)研究表明,在实验室内控温条件下,体重为72.3–139.3 g的刺参夏眠临界温度为24.5–25.5℃。
近10年来,刺参南移养殖发展迅速,但由于刺参对高温耐受性低,度夏困难,严重阻碍了刺参南移养殖活动的开展(王青林, 2012)1)。近几年来,受厄尔尼诺现象的影响,北方刺参养殖业也同样面临着高温威胁。2013年的高温造成刺参大批死亡,经济损失惨重。因此,开展刺参新品系的研究、筛选耐高温品系、提高刺参夏季养殖的成活率,对促进刺参产业的稳定发展和健康养殖具有重要的现实意义。
1) Wang QL. Effects of temperature acclimation on growth and thermotolerance of sea cucumber, Apostichopus japonicus. Master s Thesis of Ocean University of China, 2012 [王青林.温度驯化对刺参(Apostichopus japonicus)生长及耐热性的影响及生理生态学机制.中国海洋大学硕士研究生学位论文, 2012]
自2006年起,中国水产科学研究院黄海水产研究所围绕刺参良种选育工作开展了相关研究(陈宗阳,20142); Gao et al, 2015)。该团队培育的“高抗1号”新品系刺参表现出良好的耐高温特性,显示出夏季度夏期缩短、生长期延长、高温期成活率高等特点。本研究针对高温期“高抗1号”新品系刺参的活动状态及其生理变化进行了连续3年的追踪观察,为刺参抵御高温、提高养殖成活率、增产增收和良种推广提供技术参考。
2) Chen ZY. Construction and comparisons of sea cucumber (Apostichopus japonicus) full-sib families and preliminary construction of genetic linkage map. Master s Thesis of Shanghai Ocean University, 2014 [陈宗阳.刺参家系构建、抗病力评价及遗传连锁图谱的初步构建.上海海洋大学硕士研究生学位论文, 2014]
1 材料与方法 1.1 实验材料2013—2015年连续3年,在青岛瑞滋海珍品发展有限公司开展“高抗1号”新品系刺参耐高温特性与高温期生理变化的研究。实验池塘6个(其中,3个池塘养殖“高抗1号”刺参,3个池塘养殖未选育的刺参),池塘呈长方形,水深为2–3 m,每个池塘面积为3.3 hm2。池内敷设瓦片附着基。另外,每个池塘中铺设增氧管道,通过空气压缩机增氧。池中刺参为2龄,摄食状态及活力良好。每个池塘中刺参养殖密度约1头/m2,约计30000头刺参。
1.2 实验设计与管理 1.2.1 刺参养殖池水质指标测定及刺参活动规律观察在每年6–10月高温期,对耐高温新品系刺参进行池塘养殖的追踪观察。测定水质和观察刺参活动行为,比较分析耐高温品系和非选育刺参耐高温特性和夏眠等特征。
用YSI556水质测量仪每天在07:00、14:00、20:00测定每个实验组池塘的温度、盐度、溶解氧和pH,并计算日平均值。
在每个实验池塘中随机选取面积为16 m2(4 m×4 m,池中插竹竿做标记)的3块区域,观察记录在选定区域内刺参数量、摄食、排便、健康程度等情况,每天3次。同时,利用水下摄像机观察记录刺参的分布情况和活动范围。
1.2.2 刺参肠道的表观和组织形态观察实验期为每年的6–10月,该时期包括夏眠前、夏眠期和夏眠后3个时期。设置2个实验组,实验组为“高抗1号”新品系组(耐高温新品系刺参),对照组为非选育组(未经过杂交选育的刺参)。每个实验组设3个平行。
每年实验连续进行123 d。实验期间,换水方式为海水自然纳潮,每次换水量为1/5。
当水温达到25℃时,水温每升高1℃,在选定的区域内,每个实验组分别随机采样10头体重为80 g以上的刺参样本。沿刺参腹部中线解剖,比较新品系刺参和非选育刺参的肠道粗细和长度等形态,分别称重刺参体壁和内脏团,计算肠壁比(肠道重量/体壁重量)。观察相同温度条件下“高抗1号”新品系刺参和非选育组刺参夏眠中和夏眠过后肠道内容物,测量肠长、粗细、食物充盈程度。将各组织分别固定于Davidson固定液中,用常规石蜡包埋,连续切片(厚度为4–5 μm),用HE染色,在显微镜下观察并测定分析肠道绒毛膜丰度和肠脊高度。
1.2.3 不同温度下刺参消化酶活力的测定当水温持续升高,接近夏眠临界温度27℃后,水温每升高1℃,从每个实验池塘中分别随机采样10头刺参。水温下降至刚结束夏眠时(23℃和25℃),每个实验组分别采样10头刺参,采集刺参规格为80 g以上。对消化道中淀粉酶(Amylase, AMS)和胰蛋白酶(Trypsin, TRY)的活力进行测定。沿着刺参的腹部纵向剖开,取出刺参消化道的中肠,把肠道置于冰箱保鲜膜上进行操作。将刺参的肠壁沿纵向用剪刀剪开,用小刀片和镊子等工具刮下肠道里的食糜、黏膜及黏液,准确称量其重量,在其混合物中加入样本匀浆介质,配制成重量体积比为1:9的液体,在0℃条件下机械匀浆离心10 min,离心机转速为2500 r/min,吸取上清液,放置在−20℃冰箱中保存备用。使用南京建成生物工程研究所的试剂盒测定2种消化酶活力。
1.3 数据处理使用Excel 2013和SPSS 17.0软件进行数据处理和单因素方差分析(One-way ANOVA),以最小显著极差法(LSD)比较数据间显著性。数值以平均值±标准差(Mean±SD)表示,显著性水平设为0.05。
2 结果 2.1 高温期水温变化对刺参活动状态的影响养殖池塘内刺参夏眠期间最明显的生理行为就是刺参从浅水区爬行到深水区,日常活动明显减少,并逐步趋向池底硬质的附着基阴面处附着,参体萎缩、僵硬且保持不动,触手缩回无任何活动,停止摄食。本研究根据此生理特性对“高抗1号”新品系和未选育刺参在高温期的活动进行观测对比。
2013年的监测数据显示,非选育刺参在水温达到27.08℃时开始夏眠;“高抗1号”新品系刺参在水温高达29.13℃时,多数个体进入夏眠期,仍然有少量刺参在养殖池塘中爬行、摄食。在秋季水温下降期间,底层水温降至24.55℃时,“高抗1号”新品系刺参结束夏眠,而非选育刺参结束夏眠的水温为21.33℃。“高抗1号”新品系刺参夏眠期缩短了32 d。
2014年实验期间,测得的池塘底层水温、表层水温变化剧烈,其他水质指标相对变化不大。2014年6月10日底层水温为24.3℃,表层水温为25.2℃。6月10日–7月27日,受气温影响,水温呈波浪式上升。2014年7月27日水温达到最高值,底层水温为31.4℃,表层水温达到32.2℃,之后水温呈波浪式下降。池塘水深在2.2–2.8 m范围内,盐度为29.1–31.4,pH为7.3–8.7,溶解氧在4-8 mg/L之间。7月11日,水温达到28.61℃时,在非选育组刺参养殖池塘的选定区域内未见活动刺参,非选育组刺参进入夏眠,而7月20日水温升至30.47℃时,“高抗1号”新品系刺参进入夏眠。在秋季水温下降期间,“高抗1号”新品系刺参于9月17日水温降至24.94℃时结束夏眠,非选育刺参10月3日水温降至21.83℃时结束夏眠(图 1),“高抗1号”新品系刺参夏眠期缩短25 d。
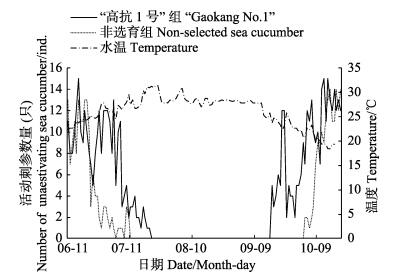
|
图 1 2014年夏眠期间刺参随温度变化的活动规律 Figure 1 Changes of sea cucumber activities during aestivation in 2014 |
在2015年实验期间,自7月12日非选育刺参在水温达到27.93℃时就已经进入夏眠;7月21日水温高达29.68℃时,“高抗1号”新品系刺参进入夏眠。9月17日水温降至24.16℃,“高抗1号”新品系刺参结束夏眠,而非选育刺参于9月30日结束夏眠的水温为22.06℃。在2015年实验期间,“高抗1号”新品系刺参与非选育刺参相比,夏眠期缩短了23 d(图 2)。
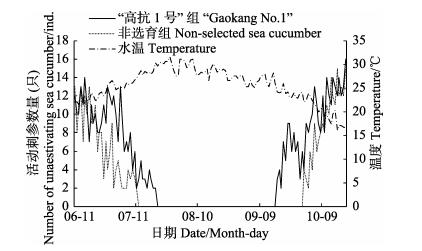
|
图 2 2015年夏眠期间刺参随温度变化的活动规律 Figure 2 Changes of sea cucumber activities during aestivation in 2015 |
刚进入夏眠期的刺参肠内仅有少量食物,消化道组织结构正常,肠道的肠系膜明显,没有显著的肠系膜退化现象。进入夏眠期以前,水温低于27℃时,对选育组和非选育组采样的刺参消化道结构差异不大。在水温达到28℃所采集的样本,“高抗1号”新品系刺参的消化道正常,表明刺参仍处于正常摄食生长期,而非选育刺参却出现了肠道萎缩、变细的现象(图 3-a、图 3-b)。当水温达到30℃时,非选育刺参和新品系刺参均进入夏眠期,消化道整体变短、变细,肠道内无食物或只有极少量食物;肠道颜色变深,多为黑色或灰褐色;前肠、中肠、后肠的特征不明显,不易区分;肠壁比减小,肠系膜退化(图 3-c、图 3-d)。另外,夏眠期刺参的呼吸树萎缩、体积变小。在秋季水温下降期间,当水温降至25℃时,“高抗1号”新品系刺参开始摄食,消化道呈饱食状态,非选育刺参仍处于肠道萎缩的夏眠状态(图 3-e、图 3-f),直至当水温降至22℃以下时,非选育刺参结束夏眠,肠道恢复正常。

|
图 3 夏眠期间刺参肠道的表观形态变化 Figure 3 The superficial morphological changes of alimentary canal of sea cucumber during aestivation period a: 28℃时“高抗1号”刺参的肠道正常,充满食物; b:28℃时非选育刺参的肠道萎缩、无食物;呼吸树萎缩; c: 30℃时“高抗1号”刺参肠道萎缩、无食物;呼吸树萎缩; d: 30℃时非选育刺参肠道萎缩、无食物;呼吸树萎缩; e: 25℃时“高抗1号”刺参肠道恢复正常,充满食物; f: 25 ℃时非选育刺参肠道萎缩、少量食物;呼吸树萎缩 a: Alimentary canal of "Gaokang No. 1"sea cucumber filled with food at 28℃; b: Alimentary canal of non-selected sea cucumber degraded and the respiratory tree atrophied at 28℃; c: Alimentary canal of "Gaokang No. 1" sea cucumber degraded and the respiratory tree atrophied at 30℃; d: Alimentary canal of non-selected sea cucumber degraded and the respiratory tree atrophied at 30℃; e: Alimentary canal of "Gaokang No. 1" sea cucumber normalized and filled with food at 25℃; f: Alimentary canal of non-selected sea cucumber degraded with little food and respiratory tree atrophied at 25℃ |
不同温度下采样刺参的平均肠长、平均肠重和肠壁比的测定结果显示,“高抗1号”新品系刺参和非选育组刺参在高温期不同温度条件下相应指标数值变化明显(表 1)。当水温达到28℃时,非选育刺参的肠长、肠重和肠壁比都显著减小,与“高抗1号”新品系刺参相比差异显著(P < 0.05)。当水温达到30℃时,非选育刺参和“高抗1号”新品系刺参先后进入夏眠状态,刺参肠长、肠重和肠壁比都较小,且差异不显著(P > 0.05)。当水温达到31℃时,“高抗1号”新品系刺参与非选育刺参肠壁比都达到最小,分别为4.1%和5.2%。当水温下降至25℃时,“高抗1号”新品系刺参组结束夏眠,与非选育刺参组相比,刺参肠长、肠重和肠壁比较大,且差异显著(P < 0.05)。当水温降至23℃时,“高抗1号”新品系刺参和非选育刺参都结束夏眠,刺参肠长、肠重和肠壁差异不显著(P > 0.05)。
|
|
表 1 不同水温下刺参肠长、肠重与肠壁比的变化 Table 1 Changes of alimentary canal length, weight and intestinal wall ratio under different temperatures |
从肠道组织切片可以看出,水温达到28℃时,“高抗1号”新品系刺参未进入夏眠,肠脊平均高度为660 μm (图 4-a);非选育刺参进入夏眠,消化道组织结构开始退化,消化道内食物不饱满,肠脊平均高度为270 μm,绒毛膜丰度降低(图 4-b)。水温达到30℃时,非选育刺参和“高抗1号”新品系刺参都进入夏眠期,消化道和呼吸树都明显退化,肠道绒毛膜丰度降低,肠脊平均高度仅为140 μm(图 4-c、图-d)。当水温降至25℃时,“高抗1号”新品系刺参又开始摄食,消化道呈饱食状态,肠脊平均高度达到最大,为640 μm(图 4-e),而此时非选育刺参消化道仍处于退化状态,绒毛膜丰度较低,肠脊平均高度为250 μm(图 4-f)。
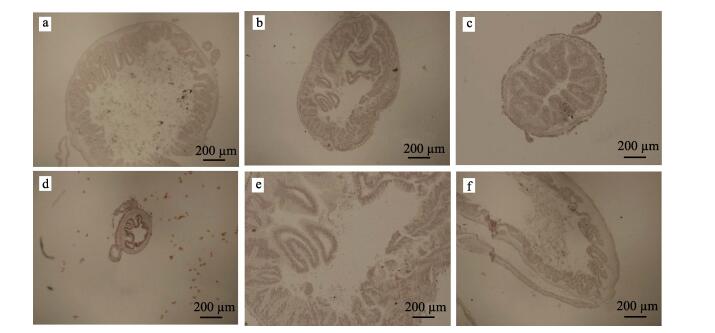
|
图 4 夏眠时期刺参肠道组织学观察 Figure 4 Intestinal histology observation of sea cucumber during aestivation period a: 28℃时“高抗1号”刺参肠道充盈、充满食物;绒毛膜丰富,肠脊高; b: 28℃时非选育刺参肠道萎缩,绒毛膜丰度降低; c: 30℃时“高抗1号”刺参肠道萎缩,绒毛膜丰度降低; d: 30℃时非选育刺参肠道严重萎缩,绒毛膜丰度大大降低,肠脊高度最低; e: 25℃时“高抗1号”刺参肠道恢复正常; f: 25℃时非选育刺参肠道仍处于萎缩状态,有少量食物 a: High intestinal chorionic abundance and normal intestinal ridge height of "Gaokang No. 1" sea cucumber at 28℃; b: Low intestinal chorionic abundance and decreased intestinal ridge height of non-selected sea cucumber at 28℃; c: Low intestinal chorionic abundance and decreased intestinal ridge height of "Gaokang No. 1"sea cucumber at 30℃; d: Low intestinal chorionic abundance and decreased intestinal ridge height of non-selected sea cucumber at 30℃; e: Intestinal chorionic abundance normalized and intestinal ridge height increased of "Gaokang No. 1"sea cucumber at 25℃; f: The intestinal chorionic abundance and intestinal ridge height of non-selected sea cucumber still unrestored at 25℃ |
高温期水温变化对“高抗1号”新品系刺参和非选育组刺参淀粉酶活力的影响结果见图 5。从图 5可以看出,随着水温由27℃上升至31℃,“高抗1号”新品系刺参淀粉酶活性呈降低趋势,水温为27℃时,淀粉酶活性在峰值,活力为6.76 U/mg prot。水温升高至30℃时,“高抗1号”新品系刺参进入夏眠,淀粉酶活性显著下降。当水温降低至25℃时,淀粉酶活力显著上升,水温降低至23℃时,刺参的淀粉酶活力与25℃时差异不显著。非选育刺参在水温由27℃升至31℃期间,淀粉酶活力持续降低,在水温为27℃时,活力为6.34 U/mg prot。当水温升高至28℃时,淀粉酶活性显著下降。水温降至25℃时,非选育刺参淀粉酶活力显著上升。水温为23℃时,非选育刺参结束夏眠,淀粉酶活力与25℃相比时显著上升。总体上来看,高温期间“高抗1号”新品系刺参比非选育刺参的淀粉酶活性要高一些。当水温为28℃、29℃、25℃时,“高抗1号”新品系刺参的淀粉酶活性高于非选育刺参,且差异显著(P < 0.05)。其他温度下2种实验组刺参的淀粉酶活性差别不大(P > 0.05)。
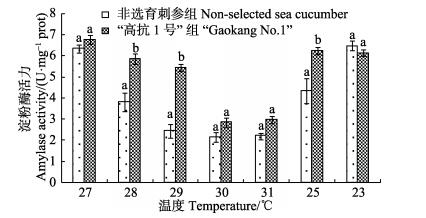
|
图 5 夏眠期温度变化对肠道淀粉酶活力的影响 Figure 5 Changes of amylase activity at different temperature during aestivation period 不同字母表示差异显著(P < 0.05),下同 Different letters indicated significant different (P < 0.05), the same as below |
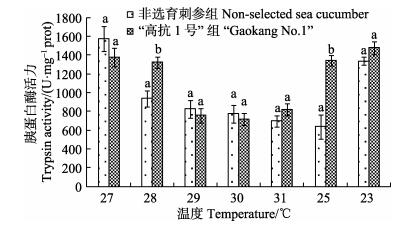
高温期水温变化对“高抗1号”新品系刺参和非选育组刺参肠道胰蛋白酶活力的影响见图 6。从图 6可以看出,在水温由27℃升至31℃的过程中,“高抗1号”新品系刺参胰蛋白酶活性表现出下降的趋势。水温为27℃时,胰蛋白酶活性为1574.07 U/mg prot。当水温降低至29℃时,胰蛋白酶活性显著下降。当水温降低至25℃时,“高抗1号”新品系刺参结束夏眠,胰蛋白酶活性开始显著上升。当水温继续降低至23℃时,胰蛋白酶活性与25℃时相比差异不显著。在水温由27℃升至31℃的过程中,非选育刺参胰蛋白酶活性表现出同样的下降趋势。水温为27℃时,胰蛋白酶活性为1375.73 U/mg prot。当水温升高至28℃时,胰蛋白酶活性显著下降。当水温降至25℃时,非选育刺参仍处于夏眠期,胰蛋白酶活性仍然很低。当水温继续降低至23℃时,胰蛋白酶活性显著上升。可见,当水温为28℃、25℃时,“高抗1号”新品系刺参的胰蛋白酶活性高于非选育刺参,且差异显著(P < 0.05)。其他温度下2种实验组刺参的胰蛋白酶活性差别不大(P > 0.05)。
|
图 6 夏眠期温度变化对肠道胰蛋白酶活力的影响 Figure 6 Changes of trypsin activity at different temperature during aestivation period |
“高抗1号”新品系刺参比非选育刺参进入夏眠临界温度平均提高了1.88℃,结束夏眠的临界温度提高了2.81℃,夏眠期平均缩短了26.7 d。一般情况下,每年刺参在池塘养殖模式下其生长时间大约为210 d (胡凡光等,2011;于明志等,2008;黄大宏等, 2008),所以,“高抗1号”新品系刺参由于其对高温的耐受力显著提升,其夏眠期缩短所带来的生长期延长对提高产能具有重要意义。
关于刺参抗逆诸如耐高温的研究报道中,刘永宏等(1996)开展了刺参养殖池塘自然条件下夏眠习性的研究,提出了不同年龄刺参进入夏眠的临界温度。Yang等(2005)研究表明,体重为72.3-139.3 g的刺参夏眠临界温度为24.5-25.5℃;这一结果与本研究非选育刺参在28℃进入夏眠的结论不同。其可能原因为:实验室内小规模温度可以精确控制,养殖实验中水温受气温等大环境影响较大,日温度变化大等。
3.2 “高抗1号”新品系刺参耐高温特性刘永宏等(1996)对不同年龄刺参进行了夏眠习性的研究,指出夏眠期刺参的肠长、肠重和肠壁比都变小。李霞等(2007)对夏眠期刺参的消化道进行了组织学观察;苏琳等(2012)、杨宁等(2014)相继在实验室人工控温的条件下进行了刺参的活动状态观察、组织学变化分析和消化酶活性变化的测定。周玮等(2009)针对池塘养殖刺参生理状态的周年变化进行了研究。但上述报道均未涉及到结束夏眠时期消化道的恢复性变化;本研究对刺参的活动状态、夏眠或结束夏眠状态、肠道表观形态、组织学形态和消化酶活性等进行了相应性跟踪研究分析,获得了更为详实的数据。
3.3 “高抗1号”新品系刺参高温期生理变化从总体上来看,在高温期相同温度条件下,“高抗1号”新品系刺参比非选育刺参的淀粉酶活力和胰蛋白酶活力都要高一些。这一现象与二者进入夏眠和结束夏眠的肠道变化相吻合,即刺参进入夏眠,刺参肠道严重退化,萎缩并无食物,肠粘膜丰度降低,肠脊高度减小,消化酶活性也伴随着降低;随着刺参结束夏眠,刺参肠道恢复正常,食物充盈,肠粘膜丰度提高,肠脊高度趋于正常,消化酶活性也提高。杨宁等(2014)研究了10-22℃实验室条件下刺参消化酶活性和变化趋势分析,也证实了随着温度的上升,胰蛋白酶活力、淀粉酶活力逐步下降,与本研究结果相似。
综上所述,“高抗1号”新品系刺参较非选育刺参夏眠期缩短,相对延长了刺参的生长期。同时,夏季高温期间,“高抗1号”新品系刺参的胰蛋白酶活力、淀粉酶活力总体上高于非选育刺参。因此,“高抗1号”新品系刺参比非选育刺参表现出更好的耐高温性状。今后,着力开展“高抗1号”新品系刺参在南、北方主产区的养殖示范,总结在不同养殖生态条件下的刺参活动、摄食规律,测定养殖周年消化酶活性和生长等有关指标,为进行良种推广提供技术参数和参考。
| Chen Y, Gao F, Liu GS, et al. The effects of temperature, salinity and light cycle on the growth and behavior of Apostichopus japonicus. Journal of Fisheries of China, 2007, 31(5): 687-691 [陈勇, 高峰, 刘国山, 等. 温度、盐度和光照周期对刺参生长及行为的影响. 水产学报, 2007, 31(5): 687-691] | |
| Gao Q, Liao MJ, Wang YG, et al. Transcriptome analysis and discovery of genes involved in immune pathways from coelomocytes of sea cucumber (Apostichopus japonicus) after Vibrio splendidus challenge. International Journal of Molecular Sciences, 2015, 16(7): 16347-16377 DOI:10.3390/ijms160716347 | |
| Hu FG, Gao X, Wang ZG, et al. Development of compact lowering ventilator noise equipment in fishing ship cabin. Fishery Modernization, 2011, 38(2): 37-40 [胡凡光, 高翔, 王志刚, 等. 刺参夏眠规律的研究. 渔业现代化, 2011, 38(2): 37-40] | |
| Huang DH, Liu GB, Sun YY, et al. Primary report on comparative experiment of population of Apostichopus japonicus (Selenka) in tolerance to temperature and quick growth. Modern Fisheries Information, 2008, 23(8): 22-25 [黄大宏, 刘广斌, 孙圆圆, 等. 刺参Apostichopus japonicus(Selenka)耐温速生群体比较实验初报. 现代渔业信息, 2008, 23(8): 22-25] | |
| Li X, Wang X. The histological observation of alimentary tract and respiratory tree in sea cucumber, Apostichopus japonicus during aestivation induced in lab. Journal of Dalian Fisheries University, 2007, 22(2): 81-85 [李霞, 王霞. 仿刺参在实验性夏眠过程中消化道和呼吸树的组织学变化. 大连海洋大学学报, 2007, 22(2): 81-85] | |
| Liu YH, Li FX, Song BX, et al. Study on aestivating habit of sea cucumber Apostichopus japonicus Selenka Ⅰecological characteristic of aestivation. Journal of Fishery Science of China, 1996, 3(2): 49-57 [刘永宏, 李馥馨, 宋本祥, 等. 刺参(Apostichopus japonicus Selenka)夏眠习性研究Ⅰ——夏眠生态特点的研究. 中国水产科学, 1996, 3(2): 49-57] | |
| Su L, Chen MY, Wang TM, et al. The division of different stages of aestivation and quantitative analysis of tissue layers thickness of anterior intestine in sea cucumber Apostichopus japonicus. Marine Sciences, 2012, 36(12): 1-5 [苏琳, 陈慕雁, 王天明, 等. 刺参夏眠不同时期划分以及前肠各组织层厚度定量分析. 海洋科学, 2012, 36(12): 1-5] | |
| Wang YG, Rong XJ, Liao MJ. Sea cucumber culture and disease control technology. Beijing: China Agriculture Press, 2014. [王印庚, 荣小军, 廖梅杰. 刺参健康养殖与病害防控技术丛解. 北京: 中国农业出版社, 2014.] | |
| Yang HS, Yuan XT, Zhou Y, et al. Effects of body size and water temperature on food consumption and growth in the sea cucumber Apostichopus japonicus (Selenka) with special reference to aestivation. Aquaculture Research, 2005, 36(11): 1085-1092 DOI:10.1111/are.2005.36.issue-11 | |
| Yang N, Wang WQ, Jiang LX, et al. Effects of water temperature on activities of digestive enzymes and immune enzymes in Apostichopus japonicus. Marine Sciences, 2014, 38(11): 56-59 DOI:10.11759/hykx20140310003 [杨宁, 王文琪, 姜令绪, 等. 水温对刺参消化酶和免疫酶活力的影响. 海洋科学, 2014, 38(11): 56-59] | |
| Yu DX, Song BX. Variation of survival rates and growth characteristics of pond cultural juvenile Apostichopus japonicus. Journal of Fishery Science of China, 1999, 6(3): 109-110 [于东祥, 宋本祥. 池塘养殖刺参幼参的成活率变化和生长特点. 中国水产科学, 1999, 6(3): 109-110] | |
| Yu MZ, Chang YQ. The effects of low temperature on some physiological phenomena in different populations of sea cucumber Apostichopus japonicus juveniles. Journal of Dalian Fisheries University, 2008, 23(1): 31-36 [于明志, 常亚青. 低温对不同群体仿刺参幼参某些生理现象的影响. 大连海洋大学学报, 2008, 23(1): 31-36] | |
| Zhou W, Xu HR, Lin CS, et al. Annual changes in physiological conditions of sea cucumber Apostichopus japonicus cultivated in a pond. Journal of Dalian Fisheries University, 2009(S1): 30-34 [周玮, 徐浩然, 林长松, 等. 池塘养殖仿刺参生理状态周年变化研究. 大连海洋大学学报, 2009(S1): 30-34] |



