2. 农业部海水养殖病害防治重点实验室 青岛市海水养殖流行病学与 生物安保重点实验室 中国水产科学研究院黄海水产研究所 青岛 266071;
3. 青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室 青岛 266071
2. Key Laboratory of Maricultural Organism Disease Control Ministry of Agriculture, Qingdao Key Laboratory of Mariculture Epidemiology and Biosecurity, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071;
3. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071
凡纳滨对虾(Litopenaeus vannamei)于1988年引入我国,经过20多年的发展,凡纳滨对虾的养殖技术已渐成熟,产量逐年增长。2001年以来,我国养殖凡纳滨对虾面积和产量一直居于对虾养殖的首位。2014年我国凡纳滨对虾的养殖产量为157.7万t,占养殖对虾总产量的90.2%。随着养殖密度的增加、水环境的恶化及对虾种质的退化,对虾疾病呈现暴发性态势,从早期的对虾白斑综合征(White Spot Disease, WSD)到现在的急性肝胰腺坏死病(Acute hepatopancreatic necrosis disease; AHPND)、虾肝肠胞虫病(Enterocytozoon hepatopenaei disease, EHPD)等,疾病种类不断增加,危害不断加强,防控难度也越来越大。微生态制剂在控制对虾疾病方面取得了良好的效果,进而在水产养殖业中得到了广泛的应用(Gatesoupe, 1999; Verschuere et al, 2000)。
芽孢杆菌(Bacillus spp.)是水产养殖业中应用最广泛的微生态制剂菌属之一(Gomez et al, 2000; Ziaei et al, 2006; Li et al, 2007; 孙艳等, 2013; 张欢欢等, 2016),其中,应用最多的包括枯草芽孢杆菌(Bacillus subtilis)、地衣芽孢杆菌(Bacillus lincheniformis)、蜡样芽孢杆菌(Bacillus cereus)、坚强芽孢杆菌(Bacillus firmus)等。生物膜(Biofilm)是指微生物为了适应环境,黏附于非生物或活性组织表面,分泌大量的多糖、蛋白质和核酸等不均一的胞外基质,将菌体自身包裹在其中而形成的大量菌体聚集膜样物,是菌体在自然界中一种常见的生存状态(Donlan et al, 2002; Hiby et al, 2014)。生物膜的形成是一个动态过程,这一过程包括细菌起始黏附期、生物膜黏附期、生长期、成熟和播散期等阶段(Renner et al, 1999),而生物膜细菌在各阶段则具有不同的生理生化特性。人工生物膜形成方法主要有试管法、微孔板法、置片法、平板膜片法、管路法、流室法、旋碟法等。本研究采用平板膜片法来生成蜡样芽孢杆菌生物膜,并将其添加到饲料中,来研究饲料中添加其对凡纳滨对虾生长速度和抗病力的影响,并通过高通量测序来研究对凡纳滨对虾肠道微生物组成的影响,藉此为蜡样芽孢杆菌生物膜的应用效果提供一定的理论依据。
1 材料与方法 1.1 对虾及养殖养殖实验于2015年7-8月在中国水产科学研究院黄海水产研究所养殖生物疾病控制与分子病理研究室养殖大棚中进行,实验对虾为凡纳滨对虾,购自青岛祥瑞种苗有限公司。挑选个体大小均匀的健康对虾放于养殖大棚暂养7 d后进行养殖实验。凡纳滨对虾体长为(5.0±0.2) cm,体重为(3.1±0.2) g,经套式PCR检测,确认呈白斑综合征病毒阴性。暂养期结束后,将该批对虾随机投放于24个100 L的养殖桶中,每桶30尾。每8个桶作为一组,将其分为生物膜组(BG)、游离态组(PG)、空白对照组(CG)。BG组投喂生物膜免疫饲料,PG组投喂游离态免疫饲料,CG组投喂基础饲料,每日早、中、晚投喂3次,日投喂量约占对虾体重的10%-15%(根据对虾摄食情况调节投喂量)。每日08:00换水,换水量约为30%-50%;水温为24-30℃,盐度为32±2,pH为8.2±0.4,连续充气。
1.2 免疫饲料制备实验全过程选用大海跃牌饲料作为基础饲料。BG组免疫饲料的制备:将蜡样芽孢杆菌PC465(由本实验室筛选、保存)接种到2216E液体培养基中,37℃过夜培养;取200 ml培养液涂布于2216E固体培养基上(Vlamakis et al, 2013),37℃培养72 h;刮取固体培养基表面培养物用PBS重悬,超声波震荡后的悬浊液添加到基础饲料中,悬浊液与饲料质量比为1:10,避光阴干后再用1%褐藻酸钠溶液粘合,经平板菌落计数确认每克饲料中含有108CFU活菌。PG组免疫饲料的制备:将蜡样芽孢杆菌PC465接种到2216E液体培养基中,37℃过夜培养;将培养液离心沉淀后用PBS重悬,将此悬浊液添加到基础饲料中,悬浊液与饲料质量比为1:10,避光阴干后再用1%褐藻酸钠溶液粘合,经平板菌落计数后确认每克饲料中含有108CFU活菌。
1.3 样本采集与处理 1.3.1 实验对虾生长状况的测定在第1、5、10、15天分别对BG组、PG组和CG组采样,每次取20尾,测量体长,计算平均体重。
1.3.2 用于肠道菌群分析样品的采集及处理在养殖第1、5、10、15、20、25天,分别对BG组、PG组和CG组采样,每次取10尾,BG组对应标号为B1、B2、B3、B4、B5W、B6V;PG组对应标号为P1、P2、P3、P4、P5W、P6V;CG组对应标号为C1、C2、C3、C4、C5W、C6V (B5W、P5W、C5W为WSSV攻毒后采样;B6V、P6V、C6V为副溶血弧菌攻毒后采样)。
用70%乙醇擦拭采样对虾的体表,并在超净台中进行活体解剖,取其完整肠道:(1) 解剖针挑开对虾肠道,刮取肠道内壁,收集肠道内容物;(2) 肠道浸于预冷PBS缓冲液中,充分震荡,于4℃放置2-4 h,800 r/min离心10 min,取上清液于新的干净1.5 ml离心管中;(3) 肠道组织以预冷PBS清洗2-3次,800 r/min离心10 min,合并上清液;(4) 将(2) 和(3) 的上清液合并后10000 r/min离心10 min,弃上清液,收集沉淀;(5) 将收集的肠道内容物和肠壁洗脱液中沉淀物混合后置于2 ml离心管,混合物包含肠道内主要微生物(李可等, 2007; 严雪平等, 2012)。
1.3.3 对虾肠道内微生物DNA的提取及16S rDNA序列V3+V4区高通量测序用粪便组基因提取试剂盒[天根生化科技(北京)有限公司]对上述得到的混合物提取DNA,将所提DNA进行1.5%聚丙烯酰胺凝胶电泳,并测定其浓度和OD260nm/OD280nm值(Nanodrop 2000)。
将采样的18份DNA样本送至北京诺禾致源生物信息科技有限公司,基于Illumina MiSeq测序平台,利用双末端测序(Paired-End)的方法,构建小片段文库进行双末端测序。首先是PCR扩增,把样品基因组DNA用无菌水稀释至1 ng/μl为模板;根据测序区域的选择,使用带Barcode的特异引物,引物对应区域为16S V4区引物515F-806R。PCR反应体系采用Phusion® High-Fidelity PCR Master Mix with GC Buffer(New England Biolabs公司),确保扩增效率和准确性。其后,根据PCR产物浓度进行等浓度混样,充分混匀后使用2%的琼脂糖凝胶电泳检测PCR产物,使用Thermo Scientific公司的GeneJET胶回收试剂盒回收产物。最后,使用New England Biolabs公司的NEB Next® Ultra™ DNA Library Prep Kit for Illumina建库试剂盒进行文库的构建,构建好的文库经过Qubit定量和文库检测,合格后,使用MiSeq进行上机测序。用Uparse软件对所有样品的全部Effective Tags序列聚类,将序列相近度达到97%的聚类成为一个OTU(Operational Taxonomic Units)。以OTUs为基础进行聚类和物种分类分析。
1.3.4 WSSV感染实验免疫饲料/基础饲料投喂的第16天,WSSV感染各组对虾停食,次日上午进行WSSV人工投喂感染实验,感染剂量为每10尾投喂2.0 g WSSV对虾病料(此剂量通过感染预实验确定)。感染后继续投喂免疫饲料/基础饲料,养殖管理同前,勤观察并及时捡出死亡或濒死对虾, 记录死亡时间和死亡数量, 14 d后感染实验结束。
1.3.5 副溶血弧菌感染实验免疫饲料/基础饲料投喂的第22天,副溶血弧菌感染各组对虾停食,次日上午进行副溶血弧菌(菌株编号20130726001s03,本实验室分离保存)感染实验。将预先活化、培养的副溶血弧菌菌液5000 r/min离心2 min,沉淀用PBS缓冲液重悬至107CFU/ml,采用反肠灌注(Sirikharin et al, 2015)的方式注射到对虾体内,感染剂量为40 μl/尾(此剂量通过预实验确定)。
1.3.6 数据分析与处理本实验采用SPSS 16.0软件对实验数据进行单因素方差(One-way ANOVA)分析,当差异显著(P < 0.05) 时用Duncan’s法作多重比较。
2 结果与分析 2.1 凡纳滨对虾的体重增长速率饲料中添加芽胞杆菌投喂后,不同时间节点BG组、PG组和CG组凡纳滨对虾体重的测定结果见表 1。从表 1可以看出,养殖15 d与1 d比较,BG组体重增长94.7%,PG组体重增长93.4%,CG组体重增长67.3%。BG组和PG组体重增长速率显著高于CG组(P < 0.05),BG组与PG组对虾体重差异性不显著(P > 0.05),BG组和PG组对虾体重与CG组对虾体重相比差异性显著(P < 0.05)。
|
|
表 1 实验期间凡纳滨对虾的体重变化 Table 1 Change of body weight of L. vannamei during experimental period (g/ind) |
|
|
表 2 养殖实验期间凡纳滨对虾的体长变化 Table 2 Change of length of L. vannamei during experimental period (cm/ind) |
实验前15 d的凡纳滨对虾体长变化见表 2。从表 2可以看出,养殖15 d与1 d比较,BG组体长增长34.6%,PG组体长增长36.9%,CG组体长增长18.3%。在10 d和15 d,BG组和PG组体长增长速率显著高于CG组(P < 0.05),BG组与PG组对虾体长相比差异不显著(P > 0.05),BG组和PG组对虾体重与CG组对虾体长相比差异性显著(P < 0.05)。
2.3 对虾肠道内容物微生物DNA的提取与组成分析本研究提取的微生物DNA浓度范围为25.5-84.7 ng/ml,OD260nm/OD280nm范围为1.77–2.05。对提取液进行1.5%聚丙烯酰胺凝胶电泳,主带清晰。18份对虾肠道微生物DNA样本的物种累积曲线见图 1。从图 1可以看出,物种累积曲线反映了随着样品数量的增加,特别是样本量大于10个后,新物种出现的速率趋于平缓,表明抽样充分。

|
图 1 18份对虾肠道微生物DNA样本的物种累积曲线 Figure 1 Species accumulation curve of shrimp gut microbes DNA among eighteen samples |
用Uparse软件(Uparse v7.0. 1001) 对所有样品的全部Effective Tags序列聚类,以97%的一致性将序列聚类成为OTUs。同一OTUs中的序列被视为是来源于某一个相同分类单元的序列,作为一个假定的分类单元,即把OTU作为生物信息学分析的基本操作分类单元。Uparse构建OTUs时会选取代表性序列(依据其算法原则,筛选的是OTUs中出现频数最高的序列),将这些代表性序列集合用RDP Classifier与GreenGene数据库进行物种注释分析。不同的“门、纲、目、科、属”均由OTUs组成。
2.4.2 样本的物种间相似性分析18份对虾肠道内容物DNA样本物种间相似性的双层聚类图(Heatmap)见图 2,图 2中结果包括样本间聚类关系树和物种(OTU)丰度相似性树。从图 2可以看出,B1、B2、B3、B4相似性较高;B6V、P6V、C6V相似性较高;C5W、P5W相似性较高,B5W与前二者相似性相对较低。结果显示,投喂蜡样芽孢杆菌BG组在实验中肠道微生物组成较稳定,变化不大。WSSV攻毒后,PG组和CG组肠道微生物组成较相似,BG组与前二者差别较大。副溶血弧菌攻毒后,BG组、PG组和CG组肠道微生物组成相似性很高。
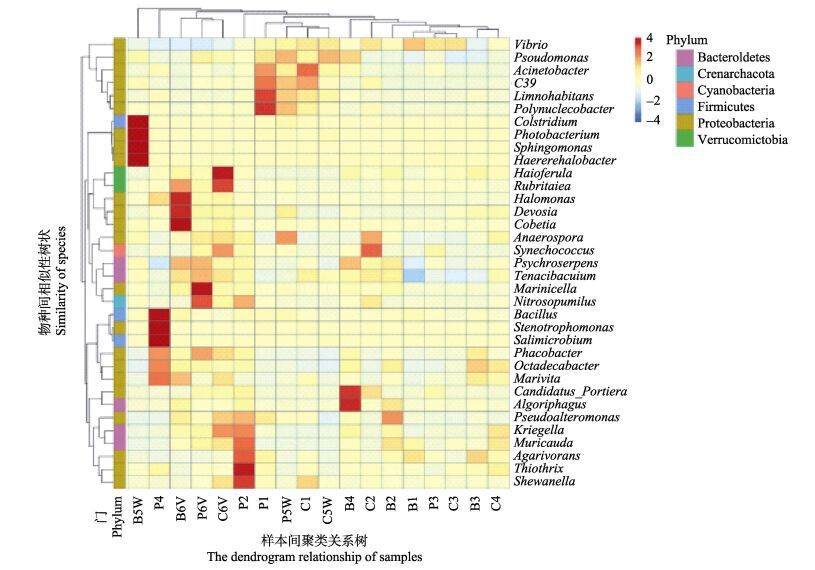
|
图 2 18份凡纳滨对虾肠道微生物DNA样本的细菌区系 Figure 2 Bacterial distribution of shrimp microbes DNA among 18 samples B:生物膜组,根据不同时间节点命名为B1、B2、B3、B4、B5W、B6V;P:游离态组,根据不同时间节点命名为P1、P2、P3、P4、P5W、P6V;C:空白对照组,根据不同时间节点命名为C1、C2、C3、C4、C5W、C6V;图 3,图 4同图 2注释 B: Biofilm group, P: Planktonic group, C: Control group. B1, B2, B3, B4, B5W, B6V were named with different time, so as P1, P2, P3, P4, P5W, P6V and C1, C2, C3, C4, C5W, C6V. Fig. 3, and Fig. 4 were the same with Fig. 2 |
|
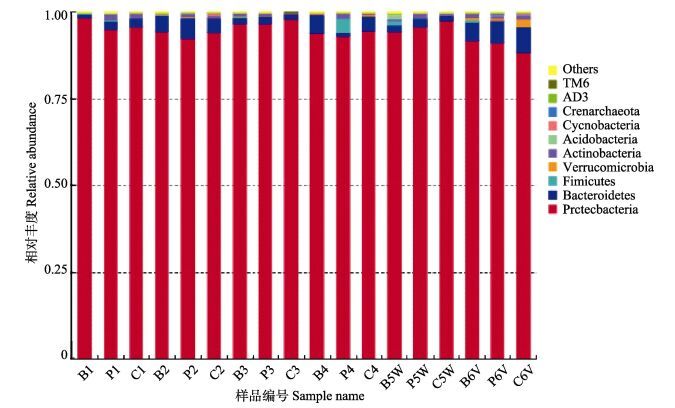
图 3 以“门”为分类单元的多样本柱状图 Figure 3 Histogram of relative abundance of taxonomy using Phylum |
|
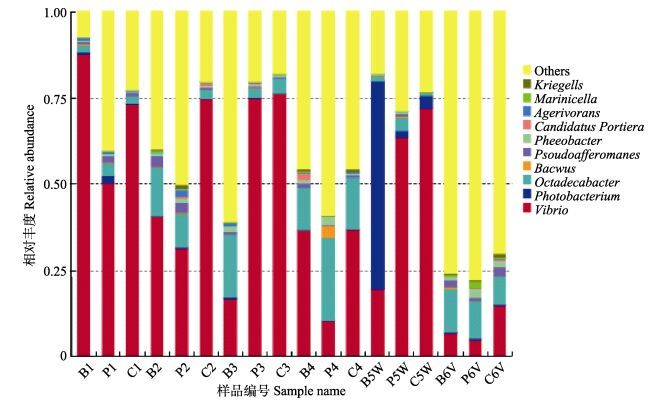
图 4 以“属”为分类单元的多样本柱状图(未命名的“属”统一为others) Figure 4 Histogram of relative abundance of taxonomy using Genus (Unnamed Genus classified as others) |
本研究分析的18份凡纳滨对虾肠道微生物的DNA样本以门为分类单位,分析结果见图 3。从图 3可以看出,实验对虾肠道内微生物主要由变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)、疣微菌门(Verrucomicrobia)、蓝藻门(Cyanophyta)、酸杆菌门(Acidobacteria)等组成,其中,变形菌门平均占到总量的94.0%。在实验第1、5、10、15、20、25天,BG组变形菌门所占比例分别为98.5%、94.3%、96.4%、93.8%、94.3%、91.7%;PG组变形菌门所占比例分别为94.9%、92.4%、96.4%、93.0%、95.6%、91.0%。CG组变形菌门所占比例分别为95.6%、94.0%、97.9%、94.5%、97.3%、88.2%。厚壁菌门在BG组和PG组所占平均比例分别为0.45%、0.93%,远高于CG组的0.02%。酸杆菌门在WSSV攻毒后才出现,其在BG组、PG组、CG组中所占比例分别为1.4%、0.1%、0.1%。
本研究分析的18份凡纳滨对虾肠道微生物DNA样本以“属”为分类单元,各属细菌所占比例见图 4。从图 4可以看出,变形菌门中主要以弧菌属(Vibrio)、发光杆菌属(Photobacterium)、Octadecabacter、假交替单胞菌属(Pseudoalteromonas)、褐杆菌属(Phaeobacter)、Agarivorans等为主;拟杆菌门中主要以黄杆菌属(Flavobacterium)为主;厚壁菌门主要以芽孢杆菌属为主。图 4中把所有未命名的属集合到了一起,并把相对丰度最高的10个属列出。相对丰度比较高的主要有弧菌属、发光杆菌属、Octadecabacter、假交替单胞菌属、褐杆菌属、黄杆菌属、Agarivorans等。各门类均检测到多种未命名的“属”,将其命名为Other。
本研究中芽孢杆菌属的含量分别为BG组:0.3%、0.2%、0.1%、0、0.2%、0.6%;PG组:0.3%、0.3%、0.1%、3.7%、0.4%、0.1%;CG组:0.1%、0、0、0、0、0。结果显示,蜡样芽孢杆菌可以通过外源补充进入到对虾肠道内,而从环境中被摄入到对虾肠道内的芽孢杆菌很少。弧菌属的含量分别为BG组:87.5%、40.7%、16.8%、36.7%、19.4%、6.8%,平均为34.65%;PG组:50.2%、31.5%、75.1%、10.3%、63.5%、5.0%,平均为39.27%;CG组:73.2%、74.7%、76.3%、37%、72%、14.8%,平均为58.0%。结果显示,BG组和PG组弧菌属含量比较接近,但明显低于CG组,各组中对虾肠道内如此高弧菌属含量仍能正常生长,猜测该弧菌属可能非有害菌。副溶血弧菌攻毒实验后引起肠道内弧菌属含量的大幅下降,可能是由于副溶血弧菌的竞争作用导致的。发光杆菌属的含量分别为BG组:0.7%、0.2%、0.3%、0、60.6%、0.2%;PG组:2.1%、0.1%、0、0、1.9%、0.3%;CG组:0.3%、0、0、0、3.7%、0.1%。结果显示,在WSSV攻毒后,凡纳滨对虾肠道内发光杆菌属含量明显升高。
2.5 攻毒实验 2.5.1 WSSV人工感染凡纳滨对虾WSSV人工感染实验结果见图 5。从图 5可以看出,CG组首先出现死亡,3个组均在第3-6天死亡率快速上升,BG组、PG组、CG组累积死亡率差异不显著。感染第14天结束实验时,BG组平均累积死亡率为80.0%,PG组平均累积死亡率为77.0%;CG组平均累积死亡率为92.0%。3个组部分死亡凡纳滨对虾体表出现白斑,所有死亡对虾经套式PCR方法检测WSSV, 第1步、第2步均呈阳性;实验攻毒后存活的对虾经套式PCR方法检测WSSV检测第1步、第2步均呈阴性。
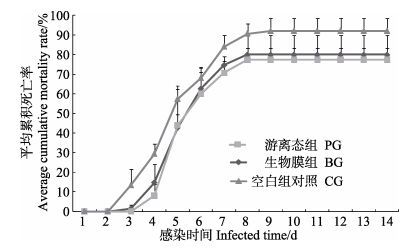
|
图 5 凡纳滨对虾感染WSSV后的累积死亡率 Figure 5 Cumulative mortality rate of L. vannamei after challenged with WSSV |
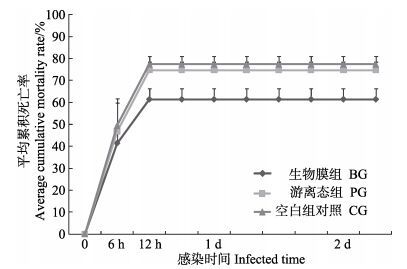
副溶血弧菌攻毒感染实验结果见图 6。从图 6可以看出,副溶血弧菌攻毒后实验凡纳滨对虾急剧死亡,并在12 h达到死亡高峰,感染第14天实验结束时,BG组平均累积死亡率为61.3%,PG组平均累积死亡率为75.0%;CG组平均累积死亡率为77.3%。12 h后,PG组与CG组累计死亡率差异不显著,BG组累计死亡率与其余2组相比差异显著(P < 0.05)。
|
图 6 凡纳滨对虾感染副溶血弧菌后的累积死亡率 Figure 6 Cumulative mortality rate of L. vannamei after challenged with V. parahaemolyticus |
芽孢杆菌是革兰氏阳性细菌,普遍存在于土壤及植物体表,也是人、动物肠道内常见的共生菌之一(Nayak, 2010; Cutting, 2011)。芽孢杆菌具有营养体-芽孢-营养体的独特生活周期史,抗逆能力强、繁殖速度快、营养要求简单,具有可抵抗酸、高温、干燥等不良环境条件等优势,适宜大规模产业化发酵生产(Irianto et al, 2002)。本研究的凡纳滨对虾肠道内容物微生物DNA-16S rDNA分析结果显示,外源补充游离态或生物膜态蜡样芽胞杆菌后,均可显著提高对虾肠道内芽孢杆菌的含量。使用常规细菌培养技术,也可以得到相类似的结论(李桂英等, 2013)。芽孢杆菌在生长过程中可分泌蛋白酶、纤维素酶、淀粉酶、几丁质酶、脂肪酶、麦芽糖酶、多聚糖降解酶、碱性蛋白酶、β-半乳糖苷酶、果聚糖酶等多种酶类,其丰富的胞外酶系不仅有助于饲料的消化吸收,还可降解内外环境中的有机残余物,促进良性生态循环。芽孢杆菌通过促进饲料的消化和吸收而加快对虾生长,在许多研究和实践中得到证实(Ziaei-Nejad et al, 2006; Wang et al, 2007; Yu et al, 2009; Van-Hai et al, 2009)。本研究结果也证实,投喂添加了蜡样芽孢杆菌饲料养殖凡纳滨对虾一段时期后,对虾的体长和体重明显高于对照组,与大多数的研究结果相近。
生物膜研究已涉及微生物学、医药工程、环境工程、生物工程、化学、物理及材料科学等诸多学科,近20年来获得许多突出成果(Wong et al, 2011)。尤其是通过对生物膜形成机理、结构稳定影响因素等方面的研究,有效控制生物膜的生长及其结构稳定,在生物生态修复、生物医学、牙医、食品等领域得到广泛应用(Hyde et al, 1997; Jahn et al, 1998; Sutherland, 2001)。但国内外在水产领域有关生物膜的研究还相对较少,而且目前有关生物膜的研究多数关注纯培养微生物,有关自然环境、人工系统中的混合菌群生物膜研究有待开展,以提高该技术的实际应用性。生物膜检测技术包括菌体技术、染色法、荧光法、激光共聚焦显微镜等,本研究采取菌体技术的方法,即通过计算生物膜中菌体对生物膜进行量化。刮取的生物膜通过超声波振荡仪振荡菌液,利用平板菌落法计算菌落形成单位(Colony forming units, CFU)对生物膜内的活菌计数(Banin et al, 2006)。本研究中副溶血弧菌和WSSV感染研究表明,将细菌生物膜投喂凡纳滨对虾能够降低死亡率,同样在Sharma等(2010)的实验中也得到了证实。Sharma等(2010)将灭活溶藻弧菌生物膜和灭活游离态溶藻弧菌添加到饲料中投喂中国对虾(Fenneropenaeus chinensis),再用溶藻弧菌、哈维氏弧菌和WSSV感染中国对虾。投喂灭活溶藻弧菌生物膜组血淋巴中细菌数量显著少于投喂灭活游离态溶藻弧菌组,其累积死亡率也显著低于灭活游离态溶藻弧菌组。投喂益生菌生物膜能够促进对虾的生长、增强免疫可能与细菌形成生物膜后产生的胞外多聚物有关,这些多糖、蛋白质和核酸等既能作为营养物质又能刺激免疫系统。
物种累积曲线是描述随着样本量的增加物种多样性增加的分析,是调查样本的物种组成和预测样本中物种丰度的有效工具,在生物多样性和群落调查中,被广泛用于样本量是否充分的判断以及物种丰富度的估计(严雪平等, 2012)。本研究在获得足够的物种丰富度基础上,对整个养殖阶段凡纳滨对虾肠道内容物微生物DNA-16S rDNA中可变区V4区进行了高通量测序,并由此分析样本物种间相似性和不同采样时间对对虾肠道微生物组成特征。在门水平上,凡纳滨对虾肠道中含量最高的是变形菌门。属水平上则主要包含弧菌属、发光杆菌属、假交替单胞菌属等。本研究中BG组弧菌属含量平均为34.65%,PG组为39.27%,CG组为58.00%。饲料中添加蜡样芽孢杆菌生物膜更易降低凡纳滨对虾肠道内微生物弧菌属的含量。推测弧菌属含量较高的原因首先是肠道弧菌属含量较高,可能是实验中换水而致的水源污染,蓄水池长期使用并未消毒可能导致弧菌滋生;其次是该弧菌种类为非致病菌或条件致病菌,从而养殖的凡纳滨对虾能够正常生长。WSSV攻毒后,PG组和CG组肠道微生物组成较相似,BG组与前二者差别较大,可能是蜡样芽孢杆菌生物膜对肠道微生物的组成有较大影响。在副溶血弧菌攻毒后,BG组、PG组和CG组肠道微生物组成相似性很高,可能是副溶血弧菌影响更加突出所致。
4 结论饲料中添加蜡样芽孢杆菌,无论是其生物膜或游离态菌株,均可以显著提高凡纳滨对虾的生长速率,且前者效果优于后者。凡纳滨对虾肠道内微生物主要由变形菌门、拟杆菌门、放线菌门、厚壁菌门、疣微菌门、蓝藻门、酸杆菌门等组成,其中,变形菌门在总量上占据绝对优势。在饲料中添加芽孢杆菌生物膜能够促使凡纳滨对虾肠道微生物更加稳定。在WSSV攻毒后,PG组和CG组肠道微生物组成较相似,BG组与前二者差别较大;在副溶血弧菌攻毒后,BG组、PG组和CG组肠道微生物组成相似性很高。饲料中添加蜡样芽孢杆菌生物膜和游离态蜡样芽孢杆菌均可显著降低凡纳滨对虾肠道内弧菌属的含量,其中,添加蜡样芽孢杆菌生物膜效果更为显著。在WSSV攻毒实验中,饲料中添加蜡样芽孢杆菌生物膜和游离态蜡样芽孢杆菌组累积死亡率低于投喂空白饲料组;在副溶血弧菌攻毒实验中,饲料中添加蜡样芽孢杆菌BG组累积死亡率显著低于投喂游离态蜡样芽孢杆菌组和投喂空白饲料组。
| Banin E, Brady KM, Greenberg EP. Chelator-induced dispersal andkilling of Pseudomonas aeruginosa cells in a biofilm. Applied and Environmental Microbiology, 2006, 72: 2064-2069 DOI:10.1128/AEM.72.3.2064-2069.2006 | |
| Cutting SM. Bacillus probiotics. Food Microbiology, 2011, 28(2): 214-220 DOI:10.1016/j.fm.2010.03.007 | |
| Donlan RM, Costerton JW. Biofilms: Survival mechanisms of clinically relevant microorganisms. Clinical Microbiology Reviews, 2002, 15(2): 167-193 DOI:10.1128/CMR.15.2.167-193.2002 | |
| Gatesoupe FJ. The use of probiotics in aquaculture. Aquaculture, 1999, 180(1): 147-165 | |
| Gomez-Gil B, Roque A, Turnbull JF. The use and selection of probiotic bacteria for use in the culture of larval aquatic organisms. Aquaculture, 2000, 191(1-3): 259-270 DOI:10.1016/S0044-8486(00)00431-2 | |
| Hiby N. A personal history of research on microbial biofilms and biofilm infections. Pathogens and Disease, 2014, 70(3): 205-211 DOI:10.1111/fim.2014.70.issue-3 | |
| Hyde FW, Alberg M, Smith K, et al. Comparison of fluorinated polymers against stainless steel, glass and polypropylene in microbial biofilm adherence and removal. Journal of Industrial Microbiology and Biotechnology, 1997, 19(2): 142-149 DOI:10.1038/sj.jim.2900448 | |
| Irianto A, Austin B. Probiotics in aquaculture. Journal of Fish Diseases, 2002, 25(11): 633-642 DOI:10.1046/j.1365-2761.2002.00422.x | |
| Jahn A, Nielsen PH. Cell biomass and exopolymer composition in sewer biofilms. Water Science and Technology, 1998, 37(1): 17-24 | |
| Sharma SR, Shankar KM, Sathyanarayana ML, et al. Evaluation of immune response and resistance to diseases in tiger shrimp. Fish and Shellfish Immunology, 2010, 29(5): 724-732 DOI:10.1016/j.fsi.2010.07.016 | |
| Li GY, Sun Y, Song XL, et al. Potential probiotics supplement may impact intestinal digestive enzyme and bacteria composition of Litopenaeus vannamei. Progress in Fishery Sciences, 2013, 34(4): 84-90 [李桂英, 孙艳, 宋晓玲, 等. 饲料中添加潜在益生菌对凡纳滨对虾肠道消化酶和菌群组成的影响. 渔业科学进展, 2013, 34(4): 84-90] | |
| Li K, Zheng T, Tian Y, et al. Beneficial effects of Bacillus licheniformis on the intestinal microflora and immunity of the white shrimp, Litopenaeus vannamei. Biotechnology Letters, 2007, 29(4): 525-530 DOI:10.1007/s10529-006-9291-4 | |
| Li K, Zheng TL, Tian Y, et al. Bacterial community structure in intestine of the white shrimp, Litopenaeus vannamei. Acta Microbiologica Sinica, 2007, 47(4): 649-653 [李可, 郑天凌, 田蕴, 等. 南美白对虾肠道微生物群落的分子分析. 微生物学报, 2007, 47(4): 649-653] | |
| Nayak SK. Probiotics and immunity: A fish perspective. Fish and Shellfish Immunology, 2010, 29(1): 2-14 DOI:10.1016/j.fsi.2010.02.017 | |
| Renner LD, Weibel DB. Physicochemical regulation of biofilm formation. MRS Bulletin, 2011, 36(5): 347-355 DOI:10.1557/mrs.2011.65 | |
| Sirikharin R, Taengchaiyaphum S, Sanguanrut P, et al. Characterization and PCR detection of binary, pir-like toxins from Vibrio parahaemolyticus isolates that cause acute hepatopancreatic necrosis disease(AHPND) in shrimp. PLOS one, 2015, 10(5): 1-16 | |
| Sun Y, Song XL, Liu F, et al. Isolation and identification of Bacillus sp.and evaluation of its effect on WSSV disease resistance in Litopenaeus vannamei. Journal of Fisheries of China, 2013, 37(4): 574-583 [孙艳, 宋晓玲, 刘飞, 等. 一株芽孢杆菌PC024的鉴定及其抗WSSV感染效果的研究. 水产学报, 2013, 37(4): 574-583] | |
| Sutherland IW. The biofilm matrix-an immobilized but dynamic microbial environment. Trends in Microbiology, 2001, 9(5): 222-227 DOI:10.1016/S0966-842X(01)02012-1 | |
| Van-Hai N, Fotedar R. Comparison of the effects of the probiotics (Bio-Mos® and β-1, 3-D-glucan) and the customised probiotics (Pseudomonas synxantha and P. aeruginosa) on the culture of juvenile western king prawns (Penaeuslatisulcatus Kishinouye, 1896). Aquaculture, 2009, 289(3-4): 310-316 DOI:10.1016/j.aquaculture.2009.02.001 | |
| Verschuere L, Rombaut G, Sorgeloos P, et al. Probiotic bacteria as biological control agents in aquaculture. Microbiology and Molecular Biology Reviews, 2000, 64(4): 655-671 DOI:10.1128/MMBR.64.4.655-671.2000 | |
| Vlamakis H, Chai Y, Beauregard P, et al. Sticking together: Building a biofilm the Bacillus subtilis way. Nature Reviews Microbiology, 2013, 11(3): 157-168 DOI:10.1038/nrmicro2960 | |
| Wang YB. Effect of probiotics on growth performance and digestive enzyme activity of the shrimp Penaeus vannamei. Aquaculture, 2007, 269(1-4): 259-264 DOI:10.1016/j.aquaculture.2007.05.035 | |
| Wong GC, Toole G. All together now: Integrating biofilm research across disciplines. MRS Bulletin, 2011, 36(5): 339-345 DOI:10.1557/mrs.2011.64 | |
| Yan XP, Yuan JB, Liu B. Solexa sequencing and analysis of the intestinal microorganisms metagenome in Litopenaeus vannamei. Marine Sciences, 2012, 36(6): 9-14 [严雪平, 袁剑波, 刘斌. 凡纳滨对虾肠道微生物宏基因组Solexa测序及其初步分析. 海洋科学, 2012, 36(6): 9-14] | |
| Yu MC, Li ZJ, Lin HZ, et al. Effects of dietary medicinal herbs and Bacillus on survival, growth, body composition, and digestive enzyme activity of the white shrimp Litopenaeus vannamei. Aquaculture International, 2009, 17(4): 377-384 DOI:10.1007/s10499-008-9209-3 | |
| Zhang HH, Wang XH, Li C, et al. Isolation and identification of a Bacillus sp. strain and its role in bioflocs for the shrimp culture system. Progress in Fishery Sciences, 2016, 37(2): 111-119 DOI:10.11758/yykxjz.20150416001 [张欢欢, 王秀华, 李晨, 等. 一株芽孢杆菌的分离鉴定及在生物絮团对虾养殖中的应用. 渔业科学进展, 2016, 37(2): 111-119] | |
| Ziaei-Nejad S, Rezaei M H, Takami G A, et al. The effect of Bacillus spp. bacteria used as probiotics on digestive enzyme activity, survival and growth in the Indian white shrimp Fenneropenaeus indicus. Aquaculture, 2006, 252(2-4): 516-524 DOI:10.1016/j.aquaculture.2005.07.021 |



