2. 农业部海洋渔业可持续发展重点实验室 中国水产科学研究院黄海水产研究所 青岛 266071;
3. 青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室 青岛 266071
2. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071;
3. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071
虾夷扇贝(Patinopecten yessoensis)属软体动物门、瓣鳃纲,为冷水性贝类。自从20世纪80年代从日本引入中国后,已经在辽宁、山东等地进行规模化养殖。辽宁省长海县是虾夷扇贝底播增殖的主要区域,到2011年底,长海县的底播面积达到43.3万hm2。随着养殖规模的扩大,底播区域逐渐从10 m水深的区域向40-50 m水深的区域扩展。黄海冷水团是位于黄海中部洼地深层及底部的低温高盐季节性水团,是我国陆架浅海的一个重要的海洋现象。夏季,黄海冷水团几乎控制着整个黄海海域,对生物群落分布、渔业资源的获得有重要的影响(李昂等, 2015)。长海县地处黄海海域,底播增殖区域受黄海冷水团锋面的影响,水温波动较大。温度异常波动可能是底播虾夷扇贝养殖过程中所面临的一个重要威胁。虾夷扇贝为冷水性种类,已有的关于水温对虾夷扇贝胁迫的研究多集中于高温的影响(王如才等, 1993; 郝振林等, 2014; 吴彪等, 2016)。那么,温度波动尤其是温度在适温范围的波动是否会对虾夷扇贝产生影响?影响程度如何?不同规格的虾夷扇贝对温度波动的反应是否有差异?目前,仅有Jiang等(2016)关于温度波动对虾夷扇贝免疫酶活性的研究报道,未见对虾夷扇贝呼吸代谢以及不同规格间的比较研究。
呼吸、排泄是反映扇贝生理状况的重要指标,而超氧化物歧化酶(SOD)、过氧化氢酶(CAT)是反映贝类体液免疫能力以及健康状态的重要指标。SOD和CAT能够增强贝类吞噬细胞的防御能力和机体的免疫功能,保护机体免受过氧化氢的损伤(姚翠鸾等, 2003)。因此,本研究以不同规格的虾夷扇贝为实验材料,根据长海县冷水团锋面区域水温的波动情况,采用室内模拟的方式,模拟海域中的温度波动时间和幅度,研究温度波动对虾夷扇贝的生理、生化指标的影响,为探讨底播增殖海域虾夷扇贝大量死亡的原因以及为底播增殖虾夷扇贝的选址提供基础数据。
1 材料与方法 1.1 实验材料实验于2015年10月在桑沟湾南岸的楮岛水产有限公司的水实验室进行。虾夷扇贝取自国家海产贝类研究中心的寻山养殖海域,按照壳长将其分为大(82.71±3.49) mm、中(65.76±4.20) mm、小(32.36±2.38) mm 3个实验组。暂养水温为15℃,暂养期间每天定量投喂三角褐指藻(Phaeodactylum tricornutum Bohlin)。暂养5 d后,分别选择大、中、小3个规格的健康、活力较强的虾夷扇贝各50粒进行实验。
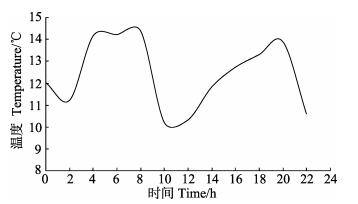
1.2 水温波动的设置黄海冷水团的核心区域位于38.5°N、122.5°E,冷水团覆盖海域面积约13万km2。而獐子岛海洋牧场的位置为38.8-39.2°N、122.4-123.1°E,处于黄海冷水团的影响范围内。獐子岛海域的潮流为半日潮,12 h涨落潮1次。因此,水温波动有一定的周期性,即12 h波动1次。水温波动范围和幅度参照獐子岛集团股份有限公司12号潜标2014年6月28日24 h监测的水温变化情况设置(图 1)。
|
图 1 獐子岛海域夏季12号潜标昼夜温度变化 Figure 1 Variation of water temperature within 24 h from #12 subsurface mooring system of Zhangzidao Island in summer |
温度波动的设置如下:由暂养的水温15℃快速降至10℃,降低速度为2.5℃/h;然后,在10℃条件下持续10 h后,再快速升至15℃,升温速度也为2.5℃/h。这样温度升降1次称为波动1次,用B1表示,波动第2次为B2,以此类推,本实验水温共波动4次。每波动1次,测1次虾夷扇贝的生理、免疫指标。另外,测定实验初始值。记录整个实验过程中虾夷扇贝的死亡数量。
1.3 测定的指标及其测定方法 1.3.1 耗氧率和排氨率的测定测定耗氧率和排氨率时,3个规格虾夷扇贝分别设置3个平行、3个空白对照组。实验所用容器为2.9 L的白色塑料瓶,大、中规格扇贝,每个塑料瓶中放置1个扇贝,小规格扇贝每个塑料瓶中放置2个。用保鲜膜密封,实验持续2 h,虹吸法取水样进行耗氧率和排氨率的测定。
溶解氧(DO)测定采用(Winkler)碘量法计算单位耗氧率(OR, mg×g-1×h-1):
| $\text{OR}=\left[ \left( \text{D}{{\text{O}}_{0}}-\text{D}{{\text{O}}_{\text{t}}} \right)\times V \right]/\left( W\times t \right)$ |
式中,DO0和DOt分别为实验开始和结束时实验水中的溶解氧含量(mg/L),V为实验用水的体积(L),W为实验贝的软组织干重(g),t为实验持续时间(h)。
氨氮(NH4-N)采用次溴酸钠氧化法测定,根据实验前后氨氮浓度变化计算单位干重排氨率(NR, μmol×g-1×h-1):
| $\text{NR}=\left[ ({{\text{N}}_{t}}-{{\text{N}}_{0}})\times V \right]/(W\times t)$ |
式中,N0和Nt分别为实验开始和结束时实验水中的氨氮浓度(μmol/L),V为实验用水的体积(L),W为实验贝的软组织干重(g),t为实验持续时间(h)。
1.3.2 血液酶活的测定采用南京建成生物工程研究所的试剂盒测量血液的SOD、CAT的活性,测量时严格按照试剂盒的说明书进行操作。
SOD的检测采用黄嘌呤氧化酶法,原理为:通过黄嘌呤以及黄嘌呤氧化酶反应体系产生O2-,后者氧化羟胺形成亚硝酸盐,在显色剂的作用下呈现紫红色,分光光度计比色,计算公式:
| $\text{SOD}活力=\frac{{{A}_{0}}-{{A}_{t}}}{{{A}_{0}}}\times 2\times \text{a}\times \text{b}$ |
式中,A0和At分别为对照管和测定管的吸光度值,a为反应体系的稀释倍数,b为样本测试前的稀释倍数。本实验测定中,a=166,b=1。
CAT的测定原理:CAT分解H2O2的反应可通过加入钼酸铵而迅速中止,剩余的H2O2与钼酸铵作用生成一种淡黄色的络合物,分光光度计比色,计算公式:
| $\text{CAT}活力=({{B}_{0}}-{{B}_{t}})\times 271\times \frac{1}{60\times c}\times \text{d}$ |
式中,B0和Bt分别为对照管和测定管的吸光度值,c为取样量(ml),d为样本测试前的稀释倍数。本实验测定中,c=10,d=1。
1.4 数据分析采用SPSS 16.0统计软件进行单因子方差分析(One-way ANOVA)和组间多重比较分析(LSD),P < 0.05视为差异显著。
2 结果 2.1 虾夷扇贝的死亡率实验中3个规格虾夷扇贝的基础生物学指标见表 1。实验期间的水体盐度为30±1。
|
|
表 1 实验所用虾夷扇贝的基础生物学数据 Table 1 The basal biological data of P. yessoensis |
不同波动次数时,不同规格组的死亡数量见表 2。温度波动4次后,大、中、小3个规格虾夷扇贝的总死亡数量分别为2、3和3个,死亡率分别为4%、6%和6%。其中,大规格虾夷扇贝的死亡率低于中、小规格,且大规格扇贝在波动前2次时出现死亡,波动第3次后,不再出现死亡。
|
|
表 2 不同规格虾夷扇贝在温度波动过程中的死亡情况 Table 2 Mortality of different sized P. yessoensis under temperature fluctuation |
温度波动对3个规格虾夷扇贝耗氧率的影响见图 2。3个规格组在B1时的耗氧率与初始相比,均为降低。随着波动次数的增加,耗氧率逐渐增加而高于初始水平。单因素方差分析显示,对3个规格组来说,波动至不同次数时的耗氧率与初始相比,均未达到显著差异(P > 0.05)。温度波动次数相同时,大规格和中规格组耗氧率不存在显著差异(P > 0.05);B0、B1、B2时,大规格组的耗氧率显著低于小规格组(P < 0.05);B3、B4时,大规格组和小规格组的耗氧率无显著差异(P > 0.05)。

|
图 2 温度波动对3个规格虾夷扇贝耗氧率的影响 Figure 2 Effects of temperature fluctuation on the oxygen consumption rate of different sized P. yessoensis |
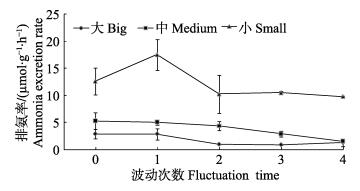
温度波动对虾夷扇贝排氨率的影响如图 3。3种规格组的排氨率除小规格组的B1外,都随着温度波动次数的增加而降低。组间多重比较分析结果显示,大规格组的B3显著低于B0(P < 0.05);中规格组的B4显著降低B0(P < 0.05);而对于小规格组,不同的波动次数之间没有达到显著性差异(P > 0.05)。
|
图 3 温度波动对3个规格虾夷扇贝排氨率的影响 Figure 3 Effects of temperature fluctuation on the ammonia excretion rate of different sized P. yessoensis |
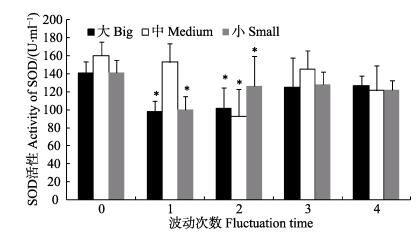
温度波动对3种规格组血液的SOD活性的影响见图 4。温度波动1次时,大规格和小规格虾夷扇贝的SOD活性显著降低;波动2次时,3个规格虾夷扇贝的SOD活性均显著低于初始值(P < 0.05)。当温度波动第3次和第4次时,3个规格虾夷扇贝的SOD活性与初始没有显著差异(P > 0.05),但均低于初始值。
|
图 4 温度波动对3个规格虾夷扇贝血液SOD活性的影响 Figure 4 Effects of temperature fluctuation on the activity of superoxide dismutase in blood of different sized P. yessoensis *表示波动组与B0差异显著(P < 0.05), 图 5同 * Represented significant difference with B0 at P < 0.05 level, the same as in Fig. 5 |
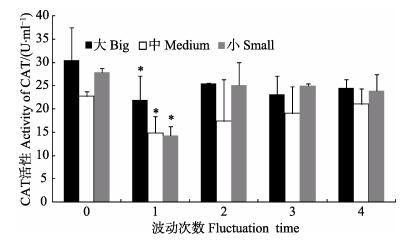
温度波动对3个规格组血液CAT活性的影响见图 5。单因素方差分析显示,温度波动对3个规格组血液CAT活性影响显著(P < 0.05)。B1时,3个规格组的CAT活性均显著降低(P < 0.05)。B3、B4时,3个规格组的CAT活性与初始相比,无显著差异(P>0.05),但均低于初始值。
|
图 5 温度波动对3个规格虾夷扇贝血液CAT活性的影响 Figure 5 Effects of temperature fluctuation on the activity of catalase in blood of different sized P. yessoensis |
温度是影响水生动物等变温动物生长、发育和代谢强度的一个非常重要的因子(王青林等, 2011)。本研究结果显示,在适温范围内的温度波动也会导致虾夷扇贝不同程度的死亡。大、中、小3个规格虾夷扇贝的死亡率没有显著性差异,中规格和小规格的死亡率略高于大规格。周玮等(1992)在研究水温异常波动与栉孔扇贝(Chlamys farreri)死亡的关系中指出,扇贝大量死亡的海域常常伴有水温异常波动,而无明显水温波动的海域扇贝死亡率偏低,将正常养殖海域内的栉孔扇贝运到海水温度出现异常波动海域,30 d后,扇贝死亡率达到20%,大幅度以及跳跃性的水温波动是导致栉孔扇贝死亡的主要原因。
3.2 温度波动对虾夷扇贝呼吸代谢的影响呼吸排泄是贝类重要的新陈代谢过程,是衡量贝类生理状态是否健康的主要指标之一。温度对贝类呼吸排泄等生理活动有很大的影响(His et al, 1989; He et al, 1999; You et al, 2001; Wang et al, 2005; Verween et al, 2007; Rico-Villa et al, 2009)。许多学者把耗氧率和排氨率作为评估水产动物在环境胁迫中利用蛋白和能量的重要有效指标(曹善茂等, 2012; 刘青等, 2012)。本研究中,随着温度波动次数的增加,3个规格虾夷扇贝的耗氧率无显著变化,小规格虾夷扇贝的排氨率无显著变化,但大规格和中规格虾夷扇贝的排氨率在B3、B4时出现降低。实验结果说明,15-10-15℃的温度波动对虾夷扇贝的生理状态影响不大,此范围内的温度波动并没有破坏虾夷扇贝正常的呼吸代谢,说明虾夷扇贝能够适应此范围内的水温波动。
Bayne(1983)提出贝类单位体重耗氧率和排氨率与个体大小成反比。在本研究中,小规格的虾夷扇贝单位软组织干重耗氧率和排氨率较大,说明小规格虾夷扇贝的代谢率较高,代谢作用较强。这与郝振林等(2014)对虾夷扇贝的研究结果一致。贝类单位组织干重耗氧率和排氨率与个体大小成反比这一规律可能与贝类组织结构和内脏器官有关,贝类直接维持生命的组织和内脏器官的新陈代谢强度高于非直接维持生命的其他组织。在贝类生长过程中,这两种组织的比率随之减小,即肌肉和脂肪等积累增多,从而引起贝类个体的增大,但单位组织耗氧率和排氨率有降低现象(王雅倩等, 2009)。
3.3 温度波动对虾夷扇贝免疫指标的影响当受到外界不良刺激时,会导致生物体内活性氧自由基增多,从而使细胞膜损害(柴学良等, 2005),生物体内活性氧代谢平衡就会被破坏,从而造成生物体受到伤害(Winston, 1991),甚至会引起生物的死亡。在长期的进化过程中,为了适应环境,生物体内都形成了一套能够及时且有效的清除活性氧自由基的机制,使其的生成与消除处于动态平衡中。SOD和CAT是这个机制中重要的2种酶(Fearman et al, 2010; 王妤等, 2011)。SOD清除自由基的能力与其活力有关。当生物体受到轻度逆境胁迫时,其体内的SOD活力往往会升高(文春报等, 2009; 时少坤等, 2013),当生物体受到重度和长时间逆境胁迫时,SOD活性通常降低(唐学玺等, 2000), 这促使生物体内蓄积活性氧,从而对生物体造成损害(张培玉等, 2007)。CAT是以铁卟啉为辅基的酶类,能将因SOD歧化反应而产生的大量H2O2及时消除,同时,也避免了因H2O2与O2-在铁络合物的作用下,而生成比O2-更具危害性的OH-自由基(温扬敏等, 2008)。同生理指标相比,虾夷扇贝的免疫指标对温度波动更为敏感。
本研究发现,在适宜温度范围内的温度波动(15-10-15℃)对虾夷扇贝的免疫指标(SOD和CAT)产生显著影响,之后,随着波动次数的增加,虾夷扇贝的免疫指标逐渐恢复。B1时CAT活性的下降和B2时SOD活性的下降可能是因为,温度波动初始,虾夷扇贝体内产生了大量的活性氧,活性氧的含量已经超过其抗氧化系统的清除能力,发生了氧化损伤,造成体内抗氧化酶的活性降低。B4时SOD和CAT的活性与初始相比,无显著差异,可能是因为此时虾夷扇贝已经适应了此范围内的温度波动,SOD和CAT活性又恢复到正常水平,这时体内活性氧的产生与消除可以达到动态平衡。孙学亮等(2010)研究急性温度胁迫对半滑舌鳎(Cynoglossus semilaevis)血液的影响时也发现,温度胁迫12 h后,其血液的SOD活性显著低于初始,而当温度胁迫96 h后,其血液的SOD活性与初始相比无显著差异。时少坤等(2013)对近江牡蛎(Crassostrea hongkongensis)的研究显示,高盐胁迫24 h时,SOD活性显著低于对照组,而48 h后,与对照组无显著差异。蒋凤华等(2012)研究发现,当栉孔扇贝受到原油水溶性成分污染24 h时,0.21 mg/L和0.88 mg/L浓度组的鳃组织SOD和CAT活性显著下降。40 μg/L的Cu2+胁迫缢蛏(Sinonovacula constricta)稚贝48 h后,其体内的CAT活性显著抑制(刘浩明等, 2012)。这些结果均与本研究的结果相似。本研究结果表明,适宜温度范围内的波动在短时期内会降低虾夷扇贝SOD和CAT活力,但长时间波动的影响不大。
综上所述,适宜温度范围内的温度波动也会对虾夷扇贝的生理、免疫指标产生不同程度的影响。温度波动会造成3个规格虾夷扇贝的死亡;虾夷扇贝对长时间的温度波动有一定的适应能力。因此,在自然海域中,黄海冷水团锋面的温度波动在波动初始期会对虾夷扇贝有较大的影响,可能导致虾夷扇贝死亡,但虾夷扇贝适应之后,这种温度波动的影响就会降低了。
| Bayne BL. The biology energetics of marine mollusks.New York: Academic Press, 1983: 407-515. | |
| Cao SM, Zhang CY, Zuo X. The effect of different ecological factors on oxygen consumption in ascidian Molgula manhattensis. Journal of Dalian Ocean University, 2012, 27(3): 210-214[曹善茂, 张丛尧, 左骁. 不同生态因子对曼氏皮海鞘耗氧率的影响. 大连海洋大学学报, 2012, 27(3): 210-214] | |
| Chai XL, Fang J, Lin ZH, et al. Effects of temperature on filtration, oxygen consumption and ammonia excretion of Mercenaria mercenaria. Marine Sciences, 2005, 29(8): 33-36[柴学良, 方军, 林志华, 等. 温度对美国硬壳蛤滤食率、耗氧率和排氨率的影响. 海洋科学, 2005, 29(8): 33-36] | |
| Fearman J, Mo1tschaniwskvj NA. Warmer temperatures reduce rates of gametogenesis in temperate mussels, Mytilus galloprovincialis. Aquaculture, 2010, 305: 20-25 DOI:10.1016/j.aquaculture.2010.04.003 | |
| Hao ZL, Tang XJ, Ding J, et al. Survival rate, oxygen consumption rate and immune enzymetic activity of Mizuhopecten yessoensis at high temperature. Chinese Journal of Ecology, 2014, 33(6): 1580-1586[郝振林, 唐雪娇, 丁君, 等. 不同高温水平对虾夷扇贝存活率、耗氧率和体腔液免疫酶活力的影响. 生态学杂志, 2014, 33(6): 1580-1586] | |
| He YC, Zhang FS, Li BQ. Effect of temperature on embryo and larval development of the scallop Argopecten irradians concentricus Say. Oceanologia Sinica, 1999, 30(3): 284-289 | |
| His E, Robert R, Dinet A. Combined effects of temperature and salinity on fed and starved larvae of the Meditererranean mussel Mytilus galloprovincialis and the Japanese oyster Crassostrea gigas. Marine Biology, 1989, 100: 455-463 DOI:10.1007/BF00394822 | |
| Jiang FH, Gao W, Zhao ML, et al. Effect of crude oil activity of antioxidant enzyme of scallop Chlamys farreri. Marine Sciences, 2012, 36(7): 28-33[蒋凤华, 高伟, 赵美丽, 等. 原油污染对栉孔扇贝抗氧化酶活性的影响. 海洋科学, 2012, 36(7): 28-33] | |
| Jiang WW, Li JQ, Gao YP, et al. Effects of temperature change on physiological and biochemical responses of Yesso scallop, Patinopecten yessoensis. Aquaculture, 2016, 451: 463-472 DOI:10.1016/j.aquaculture.2015.10.012 | |
| Li A, Yu F, Diao XY, et al. Interannual variability of temperature of the northern Yellow Sea cold water mass. Haiyang Xuebao, 2015, 37(1): 30-42 DOI:10.11978/j.issn.1009-5470.2015.01.005[李昂, 于非, 刁新源, 等. 北黄海冷水团温度年际变化研究. 海洋学报, 2015, 37(1): 30-42] | |
| Liu HM, Dong YH, Huo LH, et al. Acute toxicity of Cu2+ and its effects on antioxidant enzymes in Sinonovacula constricta juveniles. Journal of Fishery Sciences of China, 2012, 19(1): 182-187[刘浩明, 董迎辉, 霍礼辉, 等. Cu2+对缢蛏稚贝的急性毒性及对抗氧化酶活力和丙二醛含量的影响. 中国水产科学, 2012, 19(1): 182-187] | |
| Liu Q, Song YY, Xing Y, et al. Effects of temperature and salinity on oxygen consumption rate and asphyxia point in copepod Eurytemora affinis. Journal of Dalian Ocean University, 2012, 27(3): 205-209[刘青, 宋莹莹, 邢勇, 等. 温度和盐度对近亲真宽水蚤耗氧率与窒息点的影响. 大连海洋大学学报, 2012, 27(3): 205-209] | |
| Rico-Villa B, Pouvreau S, Robert R. Influence of food density and temperature on ingestion growth and settlement of Pacific oyster larvae Crassostrea gigas. Aquaculutre, 2009, 287(3-4): 395-401 DOI:10.1016/j.aquaculture.2008.10.054 | |
| Shi SK, Wang RX, Wang JY, et al. Effects of salinity stress on immune factors of Crassostrea hongkongensis. South China Fisheries Science, 2013, 9(3): 26-30[时少坤, 王瑞旋, 王江勇, 等. 盐度胁迫对近江牡蛎几种免疫因子的影响. 南方水产科学, 2013, 9(3): 26-30] | |
| Sun XL, Xing KZ, Chen CX, et al. The effects of acute temperature stress on blood parameters in half-smooth tongue-sole (Cynoglossus semilaevis). Fisheries Science, 2010, 29(7): 387-392[孙学亮, 邢克智, 陈成勋, 等. 急性温度胁迫对半滑舌鳎血液指标的影响. 水产科学, 2010, 29(7): 387-392] | |
| Tang XX, Zhang PY. Effects of anthracene on the active of Superoxide dismutase of Gymnocorymbus ternetzi. Journal of Fisheries of China, 2000, 24(3): 217-220[唐学玺, 张培玉. 蒽对黑鮶超氧化物歧化酶活性的影响. 水产学报, 2000, 24(3): 217-220] | |
| Verween A, Vincx M, Degraer S. The effect of temperature and salinity on the survival of Mytilopsis leucophaeata larve: The search for environmental limits. Journal of Experimental Marine Biology and Ecology, 2007, 348(1-2): 111-120 DOI:10.1016/j.jembe.2007.04.011 | |
| Wang DI, Xun SL, You ZJ, Lin SZ. The effects of temperature and salinity on the incubation of Cyclina sinensis and survival growth and metamorphosis of C. sinensis larvae and juveniles. Acta Hybrobiologia Sinica, 2005, 29(5): 495-501 | |
| Wang QL, Dong YW, Dong SL, et al. Effects of heat shock in pelagic stages on survival and Hsp70 expression of juvenile sea cucumber, Apostichhopus japonicus Selenka. Periodical of Ocean University of China, 2011, 41(3): 47-51[王青林, 董云伟, 董双林, 等. [高温刺激对刺参浮游期幼体存活Hsp70表达量的影响. 中国海洋大学学报, 2011, 41(3): 47-51] | |
| Wang RC, Wang ZP, Zhang JZ. The cultivation of seawater shellfish.Qingdao: Qingdao Ocean University Press, 1993. [王如才, 王召平, 张建忠. 海水贝类养殖学.青岛: 青岛海洋大学出版社, 1993.] | |
| Wang S, Zhuang P, Zhang LZ, et al. Effects of salinity on survival, growth and antioxidant defense system of Siganus guttatus. Journal of Fisheries of China, 2011, 35(1): 66-73[王妤, 庄平, 章龙珍, 等. 盐度对点篮子鱼的存活、生长抗氧化防御系统的影响. 水产学报, 2011, 35(1): 66-73] | |
| Wang YQ, Zhao W, Cheng FJ, et al. Effects of body weight and temperature on oxygen consumption and ammonia excretion in clam Mactra chinensis. Journal of Dalian Fisheries University, 2009, 24(6): 544-548[王雅倩, 赵文, 程芳晋, 等. 体重和温度对中国蛤蜊耗氧率及排氨率的影响. 大连水产学院学报, 2009, 24(6): 544-548] | |
| Wen CG, Zhang LH, Hu BQ, et al. Effects of pH on the five immune factors of Anodonta woodiana. Journal of Nanchang University, 2009, 33(2): 172-176[文春根, 张丽红, 胡宝庆, 等. pH对背角无齿蚌5种免疫因子的影响. 南昌大学学报, 2009, 33(2): 172-176] | |
| Wen YM, Gao RC, Wang S, et al. Effect of Cu2+ on the activities of immune enzyme and survival rate of Coelomactra antiquate. Shandong Fisheries, 2008, 25(4): 1-5[温扬敏, 高如承, 王帅, 等. Cu2+对西施舌免疫酶活性及成活率的影响. 齐鲁渔业, 2008, 25(4): 1-5] | |
| Winston GW. Oxidants and antioxidants in aquatic animals. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 1991, 100(1-2): 173-176 | |
| Wu B, Yang AG, Sun XJ, et al. Effects of acute temperature stress on genome-wide DNA methylation profiles in Patinopecten yessoensis. Progress in Fishery Sciences, 2016, 37(5): 140-146[吴彪, 杨爱国, 孙秀俊, 等. 急性温度胁迫对虾夷扇贝(Patinopecten yessoensis)基因组DNA甲基化的影响. 渔业科学进展, 2016, 37(5): 140-146] | |
| Yao CL, Wang WN, Wang AL. Progress of studies on superoxide dismutase in the body of aquatic animals. Marine Sciences, 2003, 27(10): 18-21 DOI:10.3969/j.issn.1000-3096.2003.10.005[姚翠鸾, 王维娜, 王安利. 水生动物体内超氧化物歧化酶的研究进展. 海洋科学, 2003, 27(10): 18-21] | |
| You ZJ, Xun SL, Bian JP, et al. The effect of sea water temperature and salinity on the growth and survival of Tegillarca granosa larvae and juveniles. Acta Oceanologica Sinica, 2001, 23(6): 108-113 | |
| Zhang PY, Tang XX, Dong SL. Effects of anthracene on differences of antioxidant enzymes activities and peroxide of membrane lipid of different tissues of Crassostrea gigas. Marine Environmental Science, 2007, 26(5): 434-437[张培玉, 唐学玺, 董双林. 蒽对太平洋牡蛎不同组织抗氧化酶活性差异性影响与膜脂质过氧化研究. 海洋环境科学, 2007, 26(5): 434-437] | |
| Zhou W, Xue ZF, Wang YJ, et al. The relation between the abnormal change of water temperature and the scallop death in Haiyang Island sea area. Transactions of Oceanology and Limnology, 1992(4): 56-62[周玮, 薛真福, 王有君, 等. 海洋岛海域水温异常波动与养殖栉孔扇贝死亡的关系. 海洋湖沼通报, 1992(4): 56-62] |



