2. 西藏自治区农牧科学院水产科学研究所 拉萨 850002
2. Institute of Fisheries Science, Tibet Academy of Agricultural and Animal Husbandry Sciences, Lasa 850002
胆汁酸是由胆固醇降解所产生的一类固醇类物质 (唐俊英, 2011),可与动物消化道中的胰脂肪酶结合,将胰脂肪酶的催化基团暴露出来并发生空间结构的改变,完全发挥胰脂肪酶的活性,完成对长链脂肪酸的消化和吸收 (杨汉博, 2008);同时,胆汁酸是动物肠道中脂类物质的乳化剂,可促进脂肪及各种脂溶性物质的消化利用。赖悦丰 (2015)研究表明,熊去氧胆酸对非酒精性脂肪肝患者的临床治疗有效率高达82.35%,较对照组提高了55.56%;沈昕等 (2015)报道,在35%的高脂饲料中添加16.70–150.00 mg/kg胆酸后可显著提高大鼠 (Rattus norvegicus) 的增重率,且高剂量的胆酸显著降低了大鼠的脂肪系数及低密度脂蛋白胆固醇 (LDL-C) 水平,说明高剂量的胆酸可促使营养性肥胖的大鼠减肥。林仕梅等 (2003)研究表明,胆汁酸能促进鲫鱼 (Carassius auratus) 生长,提高其饲料转化率,降低内脏比,改善鱼体品质。研究表明,一定浓度的胆汁酸可促进饲料脂肪的乳化,显著提高军曹鱼 (Rachycentron canadum) 的增重率,降低其体内脂肪的沉积 (周书耘等, 2010)。且胆汁酸可参与肠肝循环,具有作为信号因子调节机体代谢 (Norlin et al, 2007; Thomas et al, 2008)、抑制胃肠致癌因子 (Copaci et al, 2005)、保肝利胆 (唐精等, 2011) 及防治疾病 (张久聪等, 2008) 等作用。目前,胆汁酸在草鱼 (Ctenopharyngodon idellus) 中的研究鲜有报道。本研究拟探讨不同胆汁酸水平对草鱼生长性能、肌肉营养成分及消化酶活性的影响,以期为胆汁酸在草鱼配合饲料中的应用提供理论参考。
1 材料与方法 1.1 实验饲料以鱼粉、豆粕、菜粕、棉粕等为蛋白源,鱼油为脂肪源配制草鱼基础饲料,分别在基础饲料中添加0、75、150、225、300、375 mg/kg的胆汁酸 (胆汁酸由广东信豚饲料有限公司提供,有效成分的质量分数为15%) 配制成6种等氮等能实验饲料,饲料原料经粉碎后过60目筛,各原料按配方比例定量并逐级扩大混合均匀。用实验室小型绞肉机制成直径为1 mm的颗粒,自然晾干后于−20℃保存。基础饲料配方以及营养成分含量见表 1。
|
|
表 1 基础饲料配方及营养组成 (干物质基础,%) Table 1 Composition and nutrient levels of basal diet (Dry matter basis, %) |
实验草鱼购自重庆市双河养殖场的同一批繁殖的幼鱼,购回后用3%–5%的食盐水消毒后放入暂养池,暂养10 d后,选取健康、无伤病、初始体重为 (13.11±0.58) g的草鱼540尾,随机分成6个实验组,每组设3个重复,每个重复30尾实验鱼,随机放养在实验水族箱 (1.2 m×0.4 m×0.6 m) 中。分别投喂不同胆汁酸水平的实验饲料,养殖时间为60 d。每天表观饱食投喂3次 (08:00、12:00和19:00)。实验期间,每天换水1次,每次换水1/3。水温保持在25–30℃,pH值6.5–7.5、溶氧 > 6.0 mg/L、NH3-N < 0.2 mg/L,NO2-N > 0.01 mg/L。每日监测实验鱼的摄食行为和死亡数量等。
1.3 样品的采集在实验结束前一天对实验鱼饥饿24 h,对各实验水族箱中的草鱼称重并统计尾数,分别从每个实验组中随机抽取10尾鱼,并用50 mg/L的MS-222溶液麻醉后,称重并解剖。取出内脏,分离出肝胰脏和肠道,清除肠道内的食物,去除脂肪、肠系膜,用预冷的生理盐水冲洗干净并用滤纸吸干,将肠道分为前肠、中肠和后肠;同时,取下实验鱼背鳍以下侧线以上的肌肉,用样品袋分别将肝胰脏、各段肠道及肌肉密封,用液氮速冻后转入–80℃冰箱中保存备用。
1.4 指标的测定 1.4.1 生长性能的测定根据实验测定数据计算草鱼的增重率、特定生长率、饲料系数、成活率。
增重率 (Weight gain rate, WGR, %)=(Wt–Wo)×100/Wo
特定生长率 (Specific growth rate, SGR, %/d)= (lnWt–lnWo)×100/t
饲料系数 (Feed conversion ratio, FCR)=F/(Wt–Wo)
成活率 (Survival rate, SR, %)=100×Nt/No
式中,Wo、Wt分别为实验鱼的初始体重和终末体重 (g),t为实验时间 (d),No、Nt分别为实验开始和结束时实验鱼的尾数,F为摄食量 (g)。
1.4.2 实验饲料及肌肉营养成分的测定实验饲料及实验鱼背部肌肉粗蛋白质采用凯氏定氮法测定 (GB/T 6432-1994);粗脂肪采用索氏抽提仪测定 (GB/T 6433-1994);水分采用干燥法 (105℃) 测定 (GB 6435-1986);粗灰分采用马福炉灼烧 (550℃) 法测定 (GB/T 6438-1992)。
1.4.3 消化酶活性的测定粗酶液的制备参照叶元土等 (2015)的方法制备各段肠道、肝胰脏的粗酶液。将实验鱼的前肠、中肠、后肠和肝胰脏按组分别合并称重。分别加入相当于其重量20倍的生理盐水,迅速用冰冻玻璃匀浆器匀浆后,用离心机在3500 r/min转速下离心20 min,取其上清液作为粗酶液提取液,保存于4℃冰箱中,用于测定消化酶的活性。蛋白酶活性采用Folin-酚法测定 (中山大学生物系, 1979)。蛋白酶活性单位定义为:pH 7.4、28℃条件下,以1%的酪蛋白为底物,酶液每分钟催化生成1 µg酪氨酸的酶量为1个酶活性单位 (U);淀粉酶活性采用淀粉-碘显色法测定 (中山大学生物系, 1979)。淀粉酶活性单位定义为:pH 7.4、28℃条件下,1 g组织与底物作用30 min,水解10 mg淀粉的酶量为1个淀粉酶活性单位 (U);脂肪酶活性采用聚乙烯醇橄榄油乳化液水解法 (中山大学生物系, 1979)。脂肪酶活性单位定义为:pH 7.4、28℃条件下,1 g组织每1 h所产生1 µmol游离脂肪酸的酶量为1个酶活性单位 (U)。
1.5 数据统计与处理实验数据以平均值±标准差 (Mean±SD) 表示,采用SPSS 19.0中的单因素方差分析 (One-way ANOVA) 进行数据统计,若组间差异显著,再用Duncan氏方法进行多重比较,差异显著水平为P < 0.05。
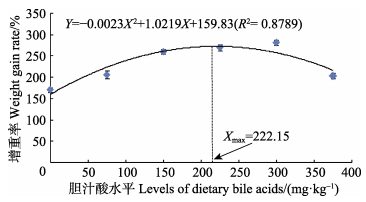
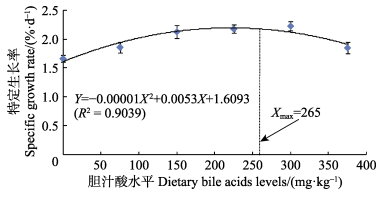
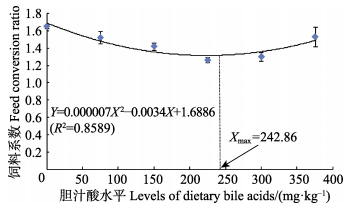
2 结果与分析 2.1 胆汁酸对草鱼生长性能的影响由表 2可知,实验草鱼的WGR、SGR均随着胆汁酸添加量的增加呈先上升后下降的趋势,且在胆汁酸添加量均为300 mg/kg时达到最大,分别为281.18%和2.23%/d,WGR显著高于对照组 (P < 0.05);SGR除与150 mg/kg组和225 mg/kg组差异不显著外 (P > 0.05),显著高于其余各实验组 (P < 0.05)。以二次回归方程可知,实验鱼WGR、SGR的回归方程分别为Y1=–0.0023X2+1.0219X+159.83(R2=0.8789)(图 1)、Y2=–0.00001X2+0.0053X+1.0693(R2=0.9039)(图 2)。在抛物线的最高点分别获得草鱼WGR、SGR的最大值,此时对应的胆汁酸添加量分别为222.15 mg/kg和265.00 mg/kg;FCR则随胆汁酸添加量的增加而呈先下降后上升的趋势,且在胆汁酸添加量为225 mg/kg时最低,为1.26,除与300 mg/kg组差异不显著 (P > 0.05) 外,显著低于其余各实验组 (P < 0.05),FCR的回归方程为Y3=0.000007X2–0.0034X+1.6886(R2=0.8589) (图 3),FCR最小时的胆汁酸添加量为242.86 mg/kg。实验期间各实验组的SR差异不显著 (P > 0.05)。
|
|
表 2 胆汁酸添加水平对草鱼生长性能的影响 (平均值±标准差, n=3) Table 2 Effects of dietary bile acids on growth of C. idellus (Mean±SD, n=3) |
|
图 1 胆汁酸添加水平对草鱼增重率的影响 Figure 1 Effects of different levels of bile acids on the weight gain rate of C. idellus |
|
图 2 胆汁酸添加水平对草鱼特定生长率的影响 Figure 2 Effects of different levels of bile acids on the specific growth rate of C. idellus |
|
图 3 胆汁酸添加水平对草鱼饲料系数的影响 Figure 3 Effects of different levels of bile acids on the feed conversion ratio of C. idellus |
由表 3可知,随着胆汁酸添加水平的提高,实验鱼肌肉中粗脂肪含量呈先下降后趋于稳定的趋势,且在添加水平为225 mg/kg时最低 (为3.51%),除显著低于对照组和75 mg/kg组 (P < 0.05) 外,与其余各实验组差异不显著 (P > 0.05);粗蛋白质含量则呈先上升后降低的变化趋势,且在胆汁酸含量为300 mg/kg时最高 (为15.05%),除与150 mg/kg组和225 mg/kg组无明显差异外 (P > 0.05),显著高于其余各实验组 (P < 0.05);各实验组水分和灰分均无明显差异 (P > 0.05)。
|
|
表 3 胆汁酸添加水平对草鱼肌肉营养成分的影响 Table 3 Effects of different levels of dietary bile acids on the muscle composition of C. idellus (%) |
由表 4可知,胆汁酸添加水平对草鱼消化酶活性有显著影响。实验鱼肠道各段及肝胰脏中,蛋白酶、脂肪酶及淀粉酶的活性均随胆汁酸添加水平的提高呈先上升后下降的变化趋势。肠道各段及肝胰脏蛋白酶活性均在胆汁酸添加量为150 mg/kg时活性最强,此时前肠、后肠及肝胰脏的蛋白酶活性显著高于其他各实验组 (P < 0.05),而中肠蛋白酶活性与胆汁酸水平为0–75 mg/kg时的差异不显著 (P > 0.05),但显著高于其他各实验组 (P < 0.05);中肠及肝胰脏脂肪酶活性在225 mg/kg组最强,前肠脂肪酶活性在300 mg/kg组最强,而后肠脂肪酶活性在150 mg/kg组最强,且均显著高于其他各实验组 (P < 0.05);前肠及后肠淀粉酶活性在150 mg/kg组最强,但此时前肠淀粉酶活性与胆汁酸水平为75–375 mg/kg时的差异不显著 (P > 0.05),而后肠淀粉酶活性显著高于其他各实验组 (P < 0.05);中肠及肝胰脏淀粉酶活性则在300 mg/kg组最强,且中肠淀粉酶活性在胆汁酸水平为225–375 mg/kg时差异不显著 (P > 0.05),肝胰脏淀粉酶活性除与225 mg/kg组差异不显著 (P > 0.05) 外,显著高于其他各实验组 (P < 0.05)。
|
|
表 4 胆汁酸添加水平对草鱼消化酶活性的影响 (鲜物质基础,U/g) Table 4 Effects of different levels of dietary bile acids on digestive enzyme activities of C. idellus (Fresh matter base, U/g) |
胆汁酸能乳化脂肪,扩大脂肪与脂肪酶的接触面积,促进鱼类对脂肪的消化吸收,提高饲料脂肪利用率 (Chou et al, 1996)。胡田恩等 (2015)研究发现,饲料中添加一定量的胆汁酸能有效提高牛蛙 (Rana catesbeiana) 的生长速度,且胆汁酸添加量为200 mg/kg时其特定生长率、饲料效率和氮保留率达到最高;胆汁酸添加量 > 300 mg/kg时能显著提高军曹鱼的增重率和饲料利用率 (周书耘等, 2010),Deshimaru等 (1982)认为,饲料中添加熊去氧胆酸能显著提高黄尾
1) Wang YJ. Effect and mechanism of several non-mutritional and non-pollution additives on turbot (Scophthalmus maximus L.). Master's Thesis of Graduate University of Chinese Academy of Sciences, 2006, 26–33 [王优军.几种非营养无公害添加剂对大菱鲆的效应和机制研究.中国科学院研究生院硕士研究生学位论文, 2006, 26–33]
2) Wang H. Effect of different lipid sources and bile acid on growth performance and fatty acid composition in Macrobrachium rosenbergii. Masterxs Thesis of Yangzhou University, 2010, 64–72 [王恒.不同脂肪源及胆汁酸对罗氏沼虾生长性能及脂肪酸组成的影响.扬州大学硕士研究生学位论文, 2010, 64–72]
3.2 胆汁酸对草鱼肌肉营养成分的影响本研究中,胆汁酸能有效降低草鱼肌肉中粗脂肪的含量,提高其粗蛋白质的含量。与对军曹鱼 (周书耘等, 2010)、大菱鲆 (孙建珍等, 2014; 黄炳山等, 2015)、罗氏沼虾 (王恒等, 2010)2)等的研究结果基本一致。说明胆汁酸能改善养殖动物肌肉品质。胆汁酸能促进动物体内脂肪的分解,提高PUFA在鱼体内的吸收和利用率 (孙建珍等, 2014)。Watanabe等 (2006)研究表明,胆汁酸可激活大鼠 (Rattus norvegicus) 褐色脂肪细胞表面G蛋白偶联胆汁酸受体 (TGR5),从而提高胞内环腺苷酸 (cAMP) 和甲状腺激素水平,加快其机体的基础代谢速度,提高机体中脂肪组织的代谢速度,改善脂肪在动物体内的转运,降低鱼体粗脂肪的含量;且胆汁酸能显著提高牛蛙对饲料氮的保留率 (胡田恩等, 2015),因此,胆汁酸可通过促进动物脂肪分解代谢而节约饲料蛋白质,提高养殖动物体内蛋白质的沉积。同时,胆汁酸降低了脂肪在肝脏中的沉积,降低了养殖鱼类脂肪肝发生的可能性 (唐精等, 2011)。说明胆汁酸可有效地改善水产动物机体营养组成,提高养殖产品品质;同时减少肝脏中脂肪的沉积,预防养殖过程中脂肪肝的发生。
3.3 胆汁酸对草鱼消化酶活性的影响消化酶活性是反映动物对营养物质消化能力的重要指标。胆汁酸能够将小肠内脂肪酶原激活为有活性的脂肪酶使其发挥作用,并能增强其酶活性 (刘敬盛等, 2010),同时胆汁酸具有特殊的生物活性,可以部分溶解肠道内容物中脂肪的分解产物,并将其从酶作用位点及时移除,避免这些产物对脂肪分解系统的抑制作用 (Bauer et al, 2005),从而促进脂肪分解生成脂肪酸,而脂肪酸水平提高又可以增强胆囊收缩素 (CCK) 的释放,进而刺激胰腺分泌消化酶 (周旭春等, 2002)。武中会等 (2008)研究发现,添加800 mg/kg胆汁酸复合乳化剂可使肉鸡胰蛋白酶、糜蛋白酶、脂肪酶活性显著提高;翟少伟等 (2015)认为,添加300 mg/kg的胆汁酸可显著提高吉富罗非鱼 (Oreochromis nibticus) 脂肪酶和蛋白酶活性。牙鲆 (Paralichthys olivaceus) 饲料中添加适宜水平的胆汁酸可显著提高其肠道脂肪酶活性 (Alam et al, 2001);牛蛙饲料中添加适宜水平的胆汁酸可显著提高其肠道蛋白酶和脂肪酶活性 (胡田恩等, 2015)。在本研究中,添加胆汁酸显著提高了草鱼肠道各段及肝胰脏中蛋白酶及脂肪酶的活性,与上述研究结果基本一致。说明胆汁酸可提高动物消化道中脂肪酶和蛋白酶的活性,促进对饲料中脂肪和蛋白质的消化吸收,促进动物的生长。研究表明,胆汁酸对幼鳗 (Anguilla anguilla)(Maita et al, 1996)、牛蛙 (胡田恩等, 2015)、吉富罗非鱼 (翟少伟等, 2015) 肠道淀粉酶活性无显著影响。本研究中,添加胆汁酸可显著提高草鱼肠道各段及肝胰脏中淀粉酶的活性,与上述研究有一定的差异。这可能与实验鱼的种类和生长发育阶段有关,具体原因还有待于进一步的研究。
4 结论胆汁酸对草鱼的生长性能、饲料转化率、肌肉营养成分及消化酶活性有显著的影响。本实验条件下,建议草鱼饲料中胆汁酸的适宜添加水平为222.15–265.00 mg/kg。
| Alam MS, Teshima S, Ishikawa M, et al. Effects of ursodeoxycholic acid on growth and digestive enzyme activities of Japanese flounder Paralichthys olivaceus (Temminck & Schlegel). Aquaculture Research, 2001, 32(S1): 235-243 | |
| Bauer E, Jakob S, Mosenthin R. Principles of physiology of lipid digestion. Asian-Australasian Journal of Animal Sciences, 2005, 18(2): 282-295 DOI:10.5713/ajas.2005.282 | |
| Biology Department of Sun Yat-sen University. Introduction to biochemical technology. Beijing: People's Education Press, 1979: 26-29 [中山大学生物系. 生化技术导论. 北京:人民教育出版社, 1979: 26-29] | |
| Chou BS, Shiau SY. Optimal dietary lipid level for growth of juvenile hybrid tilapia, Oreochromis niloticus×Oreochromis aureus. Aquaculture, 1996, 143(2): 185-195 DOI:10.1016/0044-8486(96)01266-5 | |
| Copaci I, Micu L, Iliescu L, et al. New therapeutical indications of ursodeoxycholic acid. Romanian Journal of Gastroenterology, 2005, 14(3): 259-266 | |
| Deshimaru O, Kuroki K, Yone Y. Suitable levels of lipids and ursodesoxycholic acid in diet for yellowtail (Seriola quinqueradiata). Bulletin of the Japanese Society of Scientific Fisheries, 1982, 48(9): 1265-1270 DOI:10.2331/suisan.48.1265 | |
| Hu TE, Wang L, Zhang CX, et al. Effects of dietary bile acid supplementation on the growth, whole-body composition and apparent nutrient digestibility of bullfrog (Rana Catesbeiana). Acta Hydrobiologica Sinica., 2015, 39(4): 677-685 DOI:10.7541/2015.90 [胡田恩, 王玲, 张春晓, 等. 饲料中添加胆汁酸对牛蛙生长性能、体组成和营养物质表观消化率的影响. 水生生物学报, 2015, 39(4): 677-685] | |
| Huang BS, Li BS, Zhang LM, et al. Effects of dietary bile acid on growth performance, fatty enzymatic activities and biochemical indices of turbot Scophthalmus maximus L. junveniles. Journal of Shanghai Ocean University., 2015, 24(5): 737-744 [黄炳山, 李宝山, 张利民, 等. 胆汁酸对大菱鲆幼鱼生长、脂肪代谢酶及血清生化的影响. 上海海洋大学学报, 2015, 24(5): 737-744] | |
| Lai YF. The clinical value of treatment of ursodeoxycholic acid to nonalcoholic fatty liver. Journal of Qiqihar University of Medicine, 2015, 36(7): 977-978 [赖悦丰. 熊去氧胆酸治疗非酒精性脂肪肝的临床价值分析. 齐齐哈尔医学院学报, 2015, 36(7): 977-978] | |
| Lin SM, Ye YT, Luo L. Effects of bile acid on growth of Carassius auratus gibelio. Guangdong Feed, 2003, 12(3): 14-15 [林仕梅, 叶元土, 罗莉. 胆汁酸添加剂对异育银鲫生长的影响. 广东饲料, 2003, 12(3): 14-15] | |
| Liu JS, Yang YZ, Wang JR, et al. The advances in bile acid nutritional function and mechanism. China Feed, 2010(6): 35-37, 43 [刘敬盛, 杨玉芝, 王君荣, 等. 胆汁酸营养功能及作用机制的研究进展. 中国饲料, 2010(6): 35-37, 43] | |
| Maita M, Tachiki, Kaibara A, et al. Pharmacological effect of ursodeoxycholic acid in juvenile eel. Nippon Suisan Gakkaishi, 1996, 62(1): 129-130 DOI:10.2331/suisan.62.129 | |
| Norlin M, Wikvall K. Enzymes in the conversion of cholesterol into bile acids. Current Molecular Medicine, 2007, 7(2): 199-218 DOI:10.2174/156652407780059168 | |
| Shen X, Li PF, Li X, et al. The effect of cholic acid on the lipid mobilization of diet-reduced obesity model rats. China Feed, 2015(20): 14-17 [沈昕, 李培锋, 李欣, 等. 胆酸对大鼠脂肪代谢的影响. 中国饲料, 2015(20): 14-17] | |
| Shun JZ, Wang JY, Ma JJ, et al. Effects of dietary bile acids on growth, body composition and lipid metabolism of juvenile turbot (Scophthalmus maximus) at different lipid levels. Oceanologia et Limnologia Sinica, 2014, 45(3): 617-625 DOI:10.11693/hyhz20140300092 [孙建珍, 王际英, 马晶晶, 等. 不同脂肪水平下添加胆汁酸对大菱鲆 (Scophthalmus maximus) 幼鱼生长、体组成和脂肪代谢的影响. 海洋与湖沼, 2014, 45(3): 617-625] | |
| Tan YG, Wei WZ, Zeng DS, et al. Effect of bile acids growth performance in Carassius auratus gibelio. Guangdong Feed, 2008, 17(1): 25-26 [谭永刚, 魏文志, 曾党胜, 等. 饲料中添加胆汁酸对异育银鲫生长性能的影响. 广东饲料, 2008, 17(1): 25-26] | |
| Tang JY. The use of bile acid in animal nutrition. Aquaculture Technical Advisor, 2011(9): 47 [唐俊英. 胆汁酸在动物营养中的应用. 养殖技术顾问, 2011(9): 47] | |
| Tang J, Wang JQ, Zhang BT, et al. Metabolic and physiological function of bile acids. Marine and Fisheries, 2011(7): 65-66 [唐精, 王继强, 张宝彤, 等. 胆汁酸的代谢与生理功能. 海洋与渔业, 2011(7): 65-66] | |
| Thomas C, Auwerx J, Schoonjans K. Bile acid and the membrane bile acid receptor TGR5-connecting nutrition and the metabolism. Thyroid, 2008, 18(2): 167-174 DOI:10.1089/thy.2007.0255 | |
| Watanabe M, Houten SM, Mataki C, et al. Bile acids induce energy expenditure by promoting intracellular thyroid hormone activation. Nature, 2006, 439(7075): 484-489 DOI:10.1038/nature04330 | |
| Wu ZH, Han XM. Effects of bile acid compound emulsifier on performance and digestive enzymatic activities of broilers. Journal of Animal Science and Veterinary Medicine, 2008, 27(5): 1-4 [武中会, 韩向敏. 胆汁酸复合乳化剂对肉鸡生产性能及肠道消化酶活性的影响. 畜牧兽医杂志, 2008, 27(5): 1-4] | |
| Xie ZG, Niu CJ. Effect of Kelikang on growth performance of rainbow trout Oncorhynchus mykiss. Feed Research, 2002(10): 22 DOI:10.3969/j.issn.1002-2813.2002.10.009 [颉志刚, 牛翠娟. 可利康对虹鳟生长的影响. 饲料研究, 2002(10): 22] | |
| Yang HB. Bile acid: The fat digestion accelerator. Feed China, 2008(11): 49-50 DOI:10.3969/j.issn.1002-8358.2008.11.015 [杨汉博. 胆汁酸-脂肪消化促进剂. 饲料广角, 2008(11): 49-50] | |
| Ye YT, Cai CF, Xu F, et al. Feeding grass carps (Ctenopharyngodon idellus) with oxidized fish oil up-regulates the gene expression in the cholesterol and bile acid synthesis pathway in intestinal mucosa. Acta Hydrobiologica Sinica, 2015, 39(1): 90-100 DOI:10.7541/2015.12 [叶元土, 蔡春芳, 许凡, 等. 灌喂氧化鱼油使草鱼肠道黏膜胆固醇胆汁酸合成基因通路表达上调. 水生生物学报, 2015, 39(1): 90-100] | |
| Zhai SW, Li J, Lu P, et al. Effect of different feed emulsifier on growth performance and intestinal digestive enzyme activity of tilapia. Cereal and Feed Industry, 2015, 12(15): 58-60 [翟少伟, 李剑, 陆鹏, 等. 不同饲用乳化剂对吉富罗非鱼生长性能和肠道消化酶活性的影响. 粮食与饲料工业, 2015, 12(15): 58-60] | |
| Zhang JC, Nie QH. Bile acid metabolism and related progress. Chinese Journal of Gastroenterology and Hepatology, 2008, 17(11): 953-955 DOI:10.3969/j.issn.1006-5709.2008.11.027 [张久聪, 聂青和. 胆汁酸代谢及相关进展. 胃肠病学和肝病学杂志, 2008, 17(11): 953-955] | |
| Zhou SY, Liu YJ, Liang HO, et al. Effect of bile acids on growth and body composition of cobia (Rachycentron canadum). South China Fisheries Science, 2010, 6(4): 20-25 [周书耘, 刘永坚, 梁海鸥, 等. 饲料中添加胆汁酸对军曹鱼生长及体组成的影响. 南方水产, 2010, 6(4): 20-25] | |
| Zhou XC, Tang CW. Nerve of pancreatic secretion: Hormonal regulation. Chinese Journal of Pancreatology, 2002, 2(2): 113-115 [周旭春, 唐承薇. 胰液分泌的神经-激素调节. 胰腺病学, 2002, 2(2): 113-115] |



