2. 青岛海洋科学与技术国家实验室 海洋渔业科学 与食物产出过程功能实验室 青岛 266071;
3. 上海海洋大学水产与生命学院 上海 201306
2. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071;
3. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306
半滑舌鳎(Cynoglossus semilaevis)属鲽形目(Pleuronectiformes)、舌鳎科(Cynoglossidae)、舌鳎属(Cynoglossus),是东北亚大型名贵经济鱼类,在我国近海底层广泛分布,生长速度快,肉质鲜美,深受消费者喜爱。目前,半滑舌鳎人工养殖技术已较为成熟,养殖产业规模发展迅速(柳学周等, 2005)。鱼类消化系统在机体新陈代谢过程中发挥着重要作用,是鱼类消化和营养吸收的主要场所,还具有重要的内分泌功能,对其形态和结构的研究是揭示鱼类摄食、消化和吸收等生理机制的基础和重要途径,也是人工配合饲料研制开发的重要前提。近年来,章龙珍等(2010)、陈慕雁等(2006)、胡玲玲等(2010)分别对长鳍篮子鱼(Siganus canaliculatus)、大菱鲆(Scophthalmus maximus)、条石鲷(Oplegnathus fasciatus)的消化系统进行了不同水平的研究,探明了其消化系统的结构特征,为其人工养殖的饲料研发和养殖业发展提供了理论支撑。然而,对于半滑舌鳎消化系统的研究,仅见常青等(2005)关于半滑舌鳎1-30 d仔稚鱼消化系统发生的组织学进行过报道,半滑舌鳎成鱼消化道形态和结构方面的研究尚未见报道。本文系统研究了半滑舌鳎成鱼消化道组织结构特征,并探讨了其可能的生理机能,旨在为全面认识半滑舌鳎消化生理机制和研制高效专用配合饲料提供基础资料。
1 材料与方法 1.1 实验鱼来源实验用鱼于2014年10月取自山东青岛市忠海水产有限公司养殖成体半滑舌鳎,挑选体表无伤、体色正常、游动活泼、摄食积极的个体用于实验。实验鱼使用数量为30尾,实验鱼体重为(110.955±14.954) g,体长为(22.662±3.663) cm。取样前,所有实验鱼停食12 h。
1.2 组织学观察取30尾实验鱼用于消化道的数量性状测量和组织学结构观察。取样前,实验鱼以300 mg/L的MS-222麻醉,用直尺和电子台秤测量实验鱼全长(TL)和体重(TW)。解剖开腹腔,观察消化系统各部分的形态特征。之后,迅速取出消化道,测量肠道长度(IL)用于计算肠道系数(IC=IL/TL),并测量肠道重量(GW)、肝胰脏重量(LPW),用于计算比肠重(GW/TW)、比肝胰脏重(LPW/TW)。
取实验鱼的食道、前肠、后肠组织块,以Davison固定液固定后转入70%酒精中保存。组织样品经70%-100%酒精梯度脱水,二甲苯透明,石蜡包埋,横向做连续切片(厚度为6-7 μm),苏木精-伊红(HE)染色后进行组织学观察。使用NIKON 80i型显微镜观察并拍照,利用系统自带标尺系统进行测量和标记。参照邓振旭等(2008)的研究方法,利用阿利新蓝-过碘酸雪夫氏染色法(AB-PAS,pH=2.5)对半滑舌鳎消化道各部分进行组织化学染色以显示黏液细胞。
1.3 电镜观察取10尾实验鱼用于电镜观察,实验鱼以300 mg/L麻醉剂MS-222麻醉处死,解剖取样肠道与食道连接处(食道胃)、肠道前部和后部,将各个组织样品块迅速置入2.5%戊二醛中以手术刀切取约1 mm3的小组织块,固定于4℃预冷的2.5%戊二醛中,用于扫描电镜和透射电镜观察。
扫描电镜样品制备:将样品置于2.5%戊二醛中4℃预固定24 h,之后用磷酸缓冲液(pH=7.2)冲洗3次,每次20 min,再以1%锇酸固定1 h,磷酸缓冲液冲洗,然后用30%-100%的乙醇梯度脱水,每个浓度梯度脱水10-15 min,临界点干燥器内以干冰干燥,喷金镀膜。使用JSM-840型(JEOL,日本)扫描电镜观察。
透射电镜样品制备:将样品置于2.5%戊二醛中4℃预固定24 h,之后用PBS缓冲液冲洗3次,每次20 min,再以1%锇酸固定1 h,PBS缓冲液冲洗,然后用30%-100%的丙酮梯度脱水,每个浓度梯度脱水10-15 min,最后用Epon812环氧树脂包埋、定位,半薄切片以甲苯胺蓝、醋酸双氧铀硝酸铅染色。使用JEM-1200EX透射电镜(JEOL,日本)观察。
1.4 数据统计分析消化道各部分黏膜褶皱数、黏膜褶皱高度、肌肉层(纵肌和环肌)厚度、黏液细胞相对密度等指标作为测量依据。黏膜皱褶数为消化管横切面上黏膜皱褶的个数;黏膜层褶皱高度为黏膜褶皱顶端至基部凹陷处的垂直距离;细胞的相对密度是在视野中采用曲线测量工具及计数软件统计100 μm长度的上皮中细胞的平均数量,每个指标均取10个来自不同样本相同组织的平均值,采用IPP图像分析软件(MEDIA CYBERNETICS公司,美国)分析所获得的测量数据。
本研究中所有数据表示为平均值±标准差(Mean±SD),实验结果以单因素方差分析(One-way ANOVA)统计差异显著性,使用SPSS16.0统计软件,设定差异显著性指数P为0.05,当P<0.05时为差异显著,反之差异不显著。
2 结果本研究中测量了30尾半滑舌鳎的体长、肠长、体重、肠重、肝胰脏重和内脏团重,并计算半滑舌鳎消化道指数,其中,比肠长为(0.763±0.291)、比肠重为(0.0097±0.0010)、比肝胰脏重为(0.014±0.0052)、比内脏重为(0.083±0.017)。
2.1 消化道形态特征半滑舌鳎的消化道可明显地划分为口咽腔、食道、食道胃、前肠、后肠共5部分,未见有形态上明显的胃。半滑舌鳎口下位,口咽腔小,口裂半月形,有眼侧两颌无齿,无眼侧两颌细绒毛状齿,呈窄带状排列,无犁骨牙和颚骨牙,鳃耙退化为细小尖突;有咽喉齿且较为发达,有舌,口咽腔后为食道,连接口咽腔和食道胃,较短,长度仅为消化道长度的1/15左右。饱食的半滑舌鳎在食道后方形成1个临时贮存食物的食道胃(图 1),形态上与食道分界较明显,往后延伸逐渐变细,与前肠分界不明显,颜色也无明显差异。进食消化完成后食道胃明显变小,长度和直径与肠道无差异。前肠和后肠的直径和颜色均略有差异,前肠直径较后肠略大,偏乳白色,后肠近肛门处直径变大,肠壁变薄。
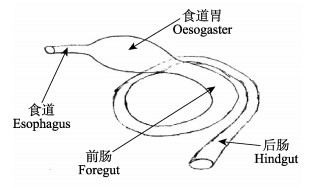
|
图 1 半滑舌鳎消化道外部形态特征示意 Figure 1 The schematic diagram of external morphology of C. semilaevisalimentary canal |
食道:组织切片观察显示,食道组织分为4层(图 2-1),由内向外依次为黏膜层、黏膜下层、肌肉层和浆膜层。食道黏膜层向食道内侧突起形成11-14条纵行褶皱(图 2-2),为黏膜褶皱,平均高度为(755.333±95.254) μm (表 1),食道前、中、后各部分黏膜褶皱形态差异很大,前部褶皱宽大,分支较多,后部逐渐变窄,分支减少直至消失。黏膜层表皮中主要细胞类型为单层柱状上皮细胞,细胞排列紧密,细胞核位于柱状细胞基底部,食道各部黏膜层表皮厚度和上皮细胞组成均有差异(图 2)。食道前部黏膜层表皮为单层柱状上皮细胞(图 2-5),经HE和AB-PAS染色可见少量形态单一的黏液细胞;食道中后部上皮变厚,经HE和AB-PAS染色明显可见3种不同类型的黏液细胞(图 2-3)。食道黏膜上皮顶端可见纹状缘(图 2-5),但食道前部纹状缘不明显(图 2-4),食道中部以后明显可见。固有层是黏膜层的组成结构之一,由致密结缔组织构成,黏膜下层由疏松结缔组织构成(图 2-2),固有层和黏膜下层分界不明显(图 2),均含有丰富的血管和神经,食道后部固有层和黏膜下层内可见少量食道腺(图 2-6);食道肌肉层很厚,为横纹肌,前部以环肌为主,偶见纵肌,食道后部才出现稳定的内部环肌和外部纵肌的结构,总厚度达(226.345±26.192) μm (表 1),内环肌较厚(图 2-2);浆膜层处于最外侧,由少量的疏松结缔组织及外侧间皮组成,易脱落(图 2-2)。

|
图 2 半滑舌鳎消化道结构显微观察
Figure 2 Microscopic observation of the digestive tract of C. semilaevis
1:食道横切整体;2:食道内壁横切;3:食道前部黏膜褶皱横切;4:食道-食道胃连接处横切;5:食道胃横切;6:食道胃黏膜褶皱横切;7:前肠横切;8:后肠横切;9:腺体横切 MF:黏膜褶皱;Mc:肌层;SM:黏膜下层;LP:固有膜;Se:浆膜;LSM:纵肌;CSM:环肌;SB:纹状缘;SeE:单层柱状上皮;Gc:杯状细胞;MuC:黏液细胞;Oe:食道;G:腺体;BV:血管;SMC:表面黏液细胞;V:微绒毛;C:腺体腔 1: Intergral transverse section of oesophadus; 2: Transverse section of oesophadus inner wall; 3: Transverse section of oesophadus mucosa fold; 4: Transverse section of junction between oesophadus and oesogaster; 5: Transverse section of oesogaster; 6: Transverse section of oesogaster mucosa fold; 7: Transverse section of foregut; 8: Transverse section of hind gut; 9: Transverse section of gland MF: Mucosa fold; Mc: Muscular coats; SM: Submucosa; LP: Lamina propria; Se: Serosa; LSM: Longitudinal layers of striated muscle; CSM: Circular layers of striated muscle; SB: Striated border; SeE: Single-layered columnar epithelium; Gc: Goblet cell; MuC: Mucous cell; Oe: Oesophagus; G: Glands; BV: Blood vessel; SMC: Surface mucous cell; V:Villus; C: Cavity |
|
|
表 1 半滑舌鳎幼鱼消化道各部分指数 Table 1 Morphological index of each segment of C. semilaevis alimentary canal (n=30) |
食道胃:半滑舌鳎没有结构明显的胃,即在组织学上没有典型的胃特征出现。进食后,食道后方与肠道前端连接处明显膨大,形成1个暂时贮存食物的食道胃,而在饥饿状态时食道胃明显缩小,甚至消失。组织学观察发现(图 2-4),该部位也由黏膜层、黏膜下层、肌肉层和浆膜层共4层构成。与食道相比,肌肉层和黏膜下层明显变薄,环肌层变化幅度较大,黏膜褶皱变得细长,黏液细胞数量增多。黏膜层向内腔突起形成纵行褶皱,横向切片显示,黏膜褶皱呈长舌状突起,在整个消化道中数量最多,达到19-22个(表 1),高度也最大,达到(1232.333±239.414) μm (表 1)。黏膜上皮为单层柱状上皮,由柱状细胞和黏液细胞组成,柱状细胞排列整齐,细胞核位于中部或基部,黏液细胞间插在柱状细胞之间,形状不一,有杯状、球状、梨状等,相对密度为(2.733±0.213)个/100 μm (表 1),与肠道前部黏液细胞相对密度没有差异,但比肠后部黏液细胞要少(P < 0.05)。黏膜上皮表面纹状缘明显。固有层和黏膜下层均分布有腺体,腺体大小不一,部分腺腔面可见黏液细胞,表面腺细胞较大,基底部含大量体积较小的圆形腺细胞,与食道后部和肠道各部分相比,该部位腺体除数量上有所增加外,结构上未见差异。固有层和黏膜下层中分布有大量血管和神经,固有层中血管较细,以毛细血管为主,而黏膜下层血管较粗大。此部位肌肉层很薄,但可明显分为环肌和纵肌,内层环肌厚度为(43.109±5.525) μm (表 1),与肠道环肌差异不显著(P < 0.05)。外层纵肌稍薄,为(26.255±4.077) μm (表 1),比肠道前部纵肌层稍厚,比肠后段薄,差异极显著。最外层浆膜可见血管,与食道浆膜层结构上无差异。
肠道:肠道基本结构也由4层构成,分别为黏膜层、黏膜下层、肌肉层和浆膜层。肠道黏膜褶皱数量相对减少(14-18个),肠前部和后部之间没有差异,高度由前到后逐渐降低,单层柱状黏膜上皮细胞排列紧密,黏液细胞丰富,肠后部含量多达(3.221±0.119)个/100 μm,与肠前部差异显著(P < 0.05)(图 2-7);前肠肌肉层厚度与囊状膨大结构没有显著性差异(P > 0.05),但到肠道后部纵肌层明显变厚(图 2-8),为(38.722±6.922) μm,达到最大;固有层和黏膜下层中,肠前部腺体仍然较多,到肠后部腺体极少见到,其他结构与囊状膨大结构基本一致。
2.3 食道胃和肠道超微结构扫描电镜观察:食道胃和肠道各部位表面结构差别不大(图 3)。在低倍镜(x2000)下,黏膜褶皱整体纵向排列,不整齐,顶端较窄,各段无明显差别。褶皱表面密布微绒毛,排列紧密,长短均一。食道胃和前肠细胞界限明显,细胞大部分呈多角形,还有部分呈圆形,圆形的较小,部分细胞交界处有分泌孔,可见分泌物;肠道后段细胞界限模糊,分泌孔数量增大。扫描电镜下还可见腺体开口(图 3-2),内壁和开口处无绒毛。

|
图 3 半滑舌鳎消化道结构超微观察
Figure 3 Microscopic observation of the digestive tract of C. semilaevis
扫描电镜:1:黏膜褶皱;2:腺体开口;3:前肠;4:后肠透射电镜:5:肠黏膜上皮;6:食道胃黏膜上皮;7:前肠;8:后肠 MF:黏膜褶皱;GO:腺体开口;CB:细胞界限;McO:黏液细胞开口;SH:分泌孔;Nu:细胞核;No:核仁;ER:内质网;Ri:核糖体;TJ:紧密连接;SV:含分泌颗粒的分泌泡;V:微绒毛;SeE:单层柱状上皮;MG:黏原颗粒;De:桥粒 Picture 1-4 were observed with scanning electron microscopy, Picture 5-8 were observed with transmission electron microscopy MF: Mucosa fold; GO: Gland openings; CB: Cell boundaries; McO: Mucous cell openings; SH: Secretion hole; Nu: Nucleus; No: Nucleolus; ER: Endoplasmic reticulum; Ri: Ribosomal; TJ: Gastric epithelial: tight junctions; SV: Secretory vesicles; V: Villus; SeE: Single-layered columnar epithelium; MG: Mucous granules; De: Desmosomes |
透射电镜观察:各部分黏膜上皮有黏液细胞,表面可见微绒毛(图 3-7),各部分微绒毛形态上无差异,但高度不同,前肠部最高,与食道胃和肠后部存在显著性差异(P<0.05)。吸收细胞呈高柱状,细胞核位于中部或基底部,椭圆形,被染色较浅,球形核仁被染成深色,明显可见(图 3-5)。细胞内含有丰富的线粒体、溶酶体、内质网等细胞器,内质网主要分布于细胞核周围,其他细胞器和分泌颗粒在细胞质上部分布密集。相邻细胞间尚可见紧密连接和中间连接、桥粒等(图 3-6),肠后部尤其丰富。黏液细胞大小和形状不同,顶部胞质内含大量黏原颗粒(图 3-9),表面微绒毛变短,向内凹陷,紧促在一起。
2.4 消化道黏液细胞数量分布特点根据AB-PAS染色结果的不同,参照邓振旭等(2008)和尹苗等(2000)的分类方法,将消化道黏液细胞分为3种类型:Ⅱ型,染色呈蓝色,AB阳性,含有酸性黏多糖;Ⅲ型,染色呈紫红色,主要含有PAS阳性的中性黏多糖,同时含有少量AB阳性的酸性黏多糖;Ⅳ型,染色呈蓝紫色,主要含有AB阳性的酸性黏多糖,同时含有少量PAS阳性的中性黏多糖。消化道切片经AB-PAS (pH为2.5)染色后观察见图 4。从图 4可以看出,消化道内黏液细胞大小不一,形状各异,有杯型、球型、梨型、椭圆型等,黏膜褶皱顶端和底部上皮中黏液细胞差异较大,顶端黏液细胞含量较多,体积相对较大,底部黏液细胞数量减少,体积也变小。各分段部位黏液细胞的类型和分布也均有差异。
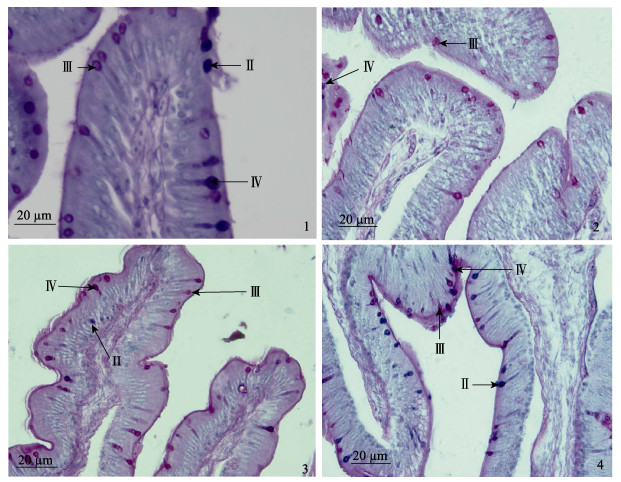
|
图 4 半滑舌鳎消化道内黏液细胞类型与分布 Figure 4 Type and distribution of mucous cells in digestive tract of C. semilaevis 1:食道后部横切;2:食道胃顶部横切;3:前肠横切;4:后肠横切;Ⅱ型黏液细胞呈蓝色;Ⅲ型黏液细胞呈紫红色;Ⅳ型黏液细胞呈蓝紫色 1: Transverse section of hind esophagus; 2: Transverse section of top oesogaster; 3: Transverse section of foregut; 4: Transverse section of hindgut Type Ⅱ mucous cells is blue; Type Ⅲ mucous cells is purple; Type Ⅳ mucous cells is blue-purple |
食道:食道各部分AB-PAS染色结果显示,食道前部仅发现杯状黏液细胞,食道中部黏液细胞形态和数量增多,到食道后部单层柱状上皮中明显可见Ⅱ型、Ⅲ型和Ⅳ型黏液细胞(图 4-1),其中,Ⅲ型黏液细胞最多,占75%,Ⅱ型黏液细胞次之,Ⅳ型黏液细胞极少,纹状缘呈紫红色。
食道胃:AB-PAS染色结果显示,食道胃单层柱状上皮细胞中黏液细胞的数量明显增加,含有Ⅱ型、Ⅲ型和Ⅳ型黏液细胞(图 4-2)。Ⅲ型黏液细胞所占比例达90%,含少量Ⅱ型和Ⅳ型黏液细胞。可见半滑舌鳎食道胃黏液细胞主要含中性黏多糖,并含少量酸性黏多糖。
肠道:AB-PAS染色结果显示,肠前部和后部均含有大量黏液细胞,同样含有Ⅱ型、Ⅲ型和Ⅳ型黏液细胞(图 4-3)。与食道胃相比,整个肠道的Ⅲ型黏液细胞的比例减少近50%,Ⅱ型和Ⅳ型黏液细胞比例增加近80%。肠道前部主要以Ⅲ型和Ⅳ型黏液细胞为主,Ⅳ型黏液细胞稍多,含少量Ⅱ型黏液细胞。肠道后部以Ⅱ型和Ⅳ型黏液细胞为主,Ⅱ型黏液细胞居多,Ⅲ型黏液细胞含量最少(图 4-4)。说明肠道黏液细胞中含有中性黏多糖和酸性黏多糖。
3 讨论本研究首次系统观察了半滑舌鳎成鱼消化道的形态学和组织学结构特征,对存在争议的“胃”进行定性分析,并对黏液细胞在消化道内的分布进行了定性和定量分析,为深入认识半滑舌鳎的消化生理特性提供了基础资料。
半滑舌鳎为底栖鱼类,食性广,对食物的软硬程度非常敏感。比肠长最能够直观地反应鱼类的食性(王晓伟等, 2008)。毕冰等(2011)研究认为,肉食性鱼类的比肠长小于1,杂食性或草食性鱼类的比肠长都大于1,本研究中比肠长指数为(0.763±0.291),说明其肉食性的特点。此外,本研究发现,半滑舌鳎整个食道的黏液分泌量相对较少,这可能是导致半滑舌鳎对食物软硬程度敏感的因素之一。半滑舌鳎消化道黏膜上皮较薄,多为单层柱状上皮,利于快速消化吸收;食道中后部上皮细胞游离面开始出现明显的纹状缘,在很大程度上增大了吸收面积,提高了消化道消化吸收效率,这与刘飞等(2011)对新型三倍体湘云鲫(Carassius auratus)、湘云鲤(Cyprinus carpio)的研究结果一致。
食道末端与肠道前端的连接部位,迄今为止还没有统一的名称,Becker等(2010)、Jaroszewska等(2008)和Ikpegbu等(2013)分别在其相关研究中称之为膨大部、过渡区和食道胃,通过对该部位的切片染色观察,本研究认为,称之为食道胃较为合适。食道胃与口咽腔、食道、前肠、后肠组成完整的消化道,而这种分段方式与Ribeiro等(2001)对塞内加尔鳎(Solea senegalensis)消化道的分段方式基本一致。形态学观察显示,食道胃在半滑舌鳎进食前后差别很大,饥饿状态下食道胃变小甚至消失,饱食状态下食道胃长度可扩大2-3倍,甚至可延伸至肠道中部。显微结构观察显示,半滑舌鳎食道胃的肌肉层相对较薄,但可以清楚地观察到横纹肌,很大程度上增加了食道胃的韧性,适于扩张,这可能与暂存食物的生理功能相适应;食道胃的黏膜褶皱发达,黏膜上皮可见纹状缘,增加了食道胃与食物的接触面积,这可能与食物的进一步消化吸收有关,甚至与前肠一起行使主要的消化吸收功能。光镜和电镜下均可见食道胃不同区域黏膜上皮和腺体的组织结构及组化反应特性基本一致,与消化道的其他部分相比差异性不明显;未观察到典型的胃小凹结构,没有典型的胃的特征,这与西伯利亚鲟(Acipenserbaerii) (陈宁宁等, 2011)、香鱼(Plecoglossus altivelis) (卢明明等, 1999)、长鳍篮子鱼(Siganus canaliculatus) (Ribeiro et al, 1999)等有胃鱼的胃小凹结构不同,但与Arellano等(2001b)对塞内加尔鳎成鱼的研究结果一致。Arellano等(2001a)研究显示,在该部位没有检测到羧酸盐或者硫酸盐的存在,并且酸性黏多糖含量很低,不符合胃的特征。综上所述,本研究结果显示,半滑舌鳎成鱼没有真正意义上的胃。常青等(2005)、万瑞景等(2004)对半滑舌鳎仔稚鱼的相关研究中指出,仔鱼前期已经形成胃,而在对半滑舌鳎成鱼的研究中没有发现真正意义上的胃,这种差异可能与半滑舌鳎不同生长阶段对生活环境的适应机制相关,其真正的原因有待进一步研究。
Sinha等(1975)研究表明,鱼类消化道黏液细胞的种类和数量与其食性、摄食方式、食物颗粒大小、生活环境和生理功能有着密切的关系。黏液细胞主要分布在鱼类皮肤和消化道的上皮中,通过分泌大量的黏液发挥重要的作用(Bovic et al, 2001; Arellano et al, 2001a),(1)润滑作用:分泌到体表可以减少体表与水的摩擦,分泌到消化道内可以润滑消化道和食物,避免摄入食物过程中的机械损伤;(2)辅助消化吸收作用:分泌物中的黏多糖类能够促进食物的消化吸收;(3)阻止自身蛋白水解以及对集约化养殖压力的适应性应答,在鱼类饥饿状态下,黏液细胞会增殖;(4)免疫作用:黏液中富含溶菌和杀菌物质,能够有效阻止病原菌的侵害。本研究结果显示,半滑舌鳎在食道前部以杯状黏液细胞为主,其内的中性黏多糖在HE染色时,被水溶解而显示透明的空泡状,分泌黏液的主要作用可能是包裹最初摄入的食物以及润滑食道,避免摄入的食物对内壁造成损伤,对食物进行初步消化;食道中部以Ⅱ型黏液细胞为主,富含酸性黏多糖,分泌黏液的主要作用可能是为食物消化提供酸性环境,为大多数消化酶创造适宜的反应条件,提高食物的消化效率;食道后部、食道胃和肠道前部均以Ⅲ型黏液细胞为主,富含中性黏多糖和酸性黏多糖,分泌的黏液可以帮助进一步消化和促进食物乳化成食糜,促进大分子物质在细胞膜的吸收和运输,行使主要的消化吸收功能,并与二糖和短链脂肪酸的吸收功能相关(辛俭等, 2013);肠后部以Ⅱ型和Ⅳ型黏液细胞为主,富含酸性黏多糖,该部位分泌物的生理作用包括:(1)润滑肠道,利于粪便的形成和排出;(2)分泌黏液中富含溶菌酶等溶菌杀菌物质,可以防止病原生物从肛门侵入体内,降低了鱼类的发病几率。已有研究显示,食物的消化主要是在消化酶的作用下分解为机体可以吸收的微小颗粒,消化酶的分泌与黏液细胞密切相关(赵帅等, 2014)。结合本研究结果,作者认为,半滑舌鳎消化道中Ⅲ型黏液细胞应为消化酶的主要分泌细胞;Ⅱ型和Ⅳ型黏液细胞可能分泌一些免疫球蛋白,增强机体的免疫防御能力。相关研究表明,鱼类的Ⅰ型黏液细胞染色呈红色,PAS反应呈阳性(邓振旭等, 2008; 尹苗等, 2000),仅含有中性黏多糖。本研究中,并没有发现半滑舌鳎肠道中分布有特征明显的Ⅰ型黏液细胞,可能是因为肠道生理功能的差异导致半滑舌鳎消化道中无Ⅰ型黏液细胞分布。半滑舌鳎消化道中不同类型的黏液细胞的分泌物中所含有的酶类、免疫球蛋白等类型和数量有待进一步探究,相关深入研究将为半滑舌鳎人工养殖过程中的饵料、免疫制剂等的选择与投喂策略提供科学依据。
| Arellano JM, Storch V, Sarasquete C. A histological and histochemical study of the oesophagus and oesogaster of the Senegal sole, Solea senegalensis. European Journal of Histochemistry , 2001a, 45 (3) : 279-294 | |
| Arellano JM, Storch V, Sarasquete C. Histological and histochemical observations in the stomach of the Senegal sole, Solea senegalensis. Histological Histopathology , 2001b, 16 (2) : 511-521 | |
| Becker AG, Gonçalves JF, Garcia IO. Morphometric parameters comparisons of the digestive tract of four teleosts with different feeding habits. Ciência Rural , 2010, 40 (2) : 862 | |
| Bi B, Sun ZW, Mao TQ, et al. Relationship between digestive tract structure and feeding habits in common carp, grass carp, silver carp and bighead carp. Chinese Journal of Fisheries , 2011, 24 (1) : 26-30 [毕冰, 孙中武, 毛天强, 等. 鲤、鲢、鳙、草鱼消化道结构与食性的研究. 水产学杂志 , 2011, 24 (1) : 26-30] | |
| Bovic FE, Srebocan E, Kozaric Z. Starvation induced pathobiology in the gut of carp (Cyprinus carpio L.). Berliner Und and Münchener Tierärztliche Wochenschrift , 2001, 114 (3-4) : 134-138 | |
| Chang Q, Chen SQ, Zhang XM, et al. Histological study of the organogenesis of the digestive system of the tonguefish, Cynoglossus semilaevis. Journal of Fisheries of China , 2005, 29 (4) : 447-453 [常青, 陈四清, 张秀梅, 等. 半滑舌鳎消化系统器官发生的组织学研究. 水产学报 , 2005, 29 (4) : 447-453] | |
| Chen MY, Zhang XM. Development of the digestive system in larval, juvenile and young turbot Scophthalmus maximus. Acta Hydrobiologica Sinica , 2006, 30 (2) : 236-240 [陈慕雁, 张秀梅. 大菱鲆仔稚幼鱼消化系统发育的组织学研究. 水生生物学报 , 2006, 30 (2) : 236-240] | |
| Chen NN, Zhang LZ, Zhuang P, et al. On morphology and histology of the digestive tract in Siberian sturgeon Acipenserbaerii. Marine Fisheries , 2011, 33 (1) : 20-27 [陈宁宁, 章龙珍, 庄平, 等. 西伯利亚鲟消化道形态学和组织学的初步研究. 海洋渔业 , 2011, 33 (1) : 20-27] | |
| Deng ZX, Chu DC, Li CH. Histochemistry staining of mucous cells on digestive tract of three species freshwater fish. Biotechnology , 2008, 18 (2) : 42-44 [邓振旭, 楚德昌, 李春华. 三种淡水鱼消化道黏液细胞的组织化学染色. 生物技术 , 2008, 18 (2) : 42-44] | |
| Hu LL, Li JE, Ou YJ, et al. Study on morphology and histology of digestive tract in cultured Oplegnathus fasciatus. South China Fisheries Science , 2010, 6 (6) : 65-69 [胡玲玲, 李加儿, 区又君, 等. 养殖条石鲷消化道形态构造及组织学观察. 南方水产 , 2010, 6 (6) : 65-69] | |
| Ikpegbu E, Ezeasor DN, Nlebedum UC, et al. Morphological and histochemical observations on the oesogaster of the domesticated African catfish (Clarias gariepinus Burchell, 1822). Bulgarian Journal of Veterinary Medicine , 2013, 16 (2) : 88-95 | |
| Jaroszewska MK, Dabrowsk KB, Wikzynska B, et al. Structure of the gut of the racer gobly Neogobius gymnotrachelus(Kebsler, 1857). Journal of Fish Biology , 2008, 72 (2) : 1773-1786 | |
| Liu F, Zhang XJ, Liu SJ, et al. Histological studies on the digestive tracts in Carassius auratus Triploid and Cyprinus carpioTriploid. Journal of Fishery Sciences of China , 2001, 8 (3) : 23-32 [刘飞, 张轩杰, 刘少军, 等. 湘云鲫、湘云鲤消化道的组织学研究. 中国水产科学 , 2001, 8 (3) : 23-32] | |
| Liu XZ, Zhuang ZM, Ma AJ, et al. Reproductive biology and breeding technology of Cynoglossus semilaevisGünther. Marine Fisheries Research , 2005, 26 (5) : 7-14 [柳学周, 庄志猛, 马爱军, 等. 半滑舌鳎繁殖生物学及繁育技术研究. 海洋水产研究 , 2005, 26 (5) : 7-14] | |
| Lu MM, Li HH, Lan JQ, et al. Morphology of the digestive tract and liver of Plecoglossus altivelis. Journal of Biology , 2012, 29 (5) : 25-28 [卢明明, 李海燕, 竺俊全, 等. 香鱼消化道及肝脏的形态结构特征. 生物学杂志 , 2012, 29 (5) : 25-28] | |
| Ribeiro L, Sarasquete C, Dinis MT. Histological and histochemical development of the digestive system ofSolea senegalensis(Kaup, 1858) larvae. Aquaculture , 1999, 171 (8) : 293-308 | |
| Sinha GM. A histochemical study of the mucous cells in the bucco-pharyngeal region of four Indian freshwater fishes in relation to their origin, development, occurrence and probable functions. Acta Histochemica , 1975, 53 (2) : 127-150 | |
| Wan RJ, Jiang YW, Zhuang ZM. Morphological and developmental characters at the early stages of the tonguefish Cynoglossus semilaevis. Acta Zoologica Sinica , 2004, 50 (1) : 193-201 [万瑞景, 姜言伟, 庄志猛. 半滑舌鳎早期形态及发育特征. 动物学报 , 2004, 50 (1) : 193-201] | |
| Wang XW, Li J, Xiao ZZ, et al. Primary research on morphologic characteristics and inner structure of barfin flounder Verasper moseri. Marine Sciences , 2008, 32 (5) : 90-97 [王晓伟, 李军, 肖志忠, 等. 条斑星鲽外部形态特征与内部组织器官的初步研究. 海洋科学 , 2008, 32 (5) : 90-97] | |
| Xiao ZZ, Yu DD, Xin M, et al. Ontogeny of digestive system during early development stage of barfin flounder. Marine Sciences , 2008, 32 (6) : 13-17 [肖志忠, 于道德, 辛梅, 等. 条斑星鲽消化系统个体发生的组织学观察. 海洋科学 , 2008, 32 (6) : 13-17] | |
| Xin J, Xue BG, Lou B, et al. The type and distribution of mucous cells in the digestive tract of Nibea albiflora. Journal of Zhejiang Ocean University (Natural Science) , 2013, 32 (1) : 10-14 [辛俭, 薛宝贵, 楼宝, 等. 黄姑鱼消化道黏液细胞的类型和分布. 浙江海洋学院学报 , 2013, 32 (1) : 10-14] | |
| Yin M, An LG, Yang GW, et al. Study on the type of mucous cells in carps (Cyprinus carpio). Chinese Journal of Zoology , 2000, 35 (1) : 8-10 [尹苗, 安利国, 杨桂文, 等. 鲤鱼黏液细胞类型的研究. 动物学杂志 , 2000, 35 (1) : 8-10] | |
| Zhang LZ, Yang JH, Zhao F, et al. Microstructure and ultrastructure observation of the digestive tract of Siganus canaliculatus. Journal of Fisheries of China , 2010, 34 (2) : 271-277 DOI:10.3724/SP.J.1231.2010.06517 [章龙珍, 杨金海, 赵峰, 等. 长鳍篮子鱼消化道显微与超微结构观察. 水产学报 , 2010, 34 (2) : 271-277] | |
| Zhao S, Zhu ZH, WU YY, et al. Histochemical localization of mucous cells and five types of enzymes in digestive tract of Alligator sinensis. Acta Hydrobiologica Sinica , 2014, 38 (5) : 962-967 [赵帅, 朱红年, 吴媛媛, 等. 扬子鳄消化道黏液细胞和5种酶的组织化学定位. 水生生物学报 , 2014, 38 (5) : 962-967] |



