2. 农业部海洋渔业可持续发展重点实验室 山东省渔业资源与生态环境重点实验室 中国水产科学研究院黄海水产研究所 青岛 266071;
3. 青岛海洋科学与技术国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266071
2. Key Laboratory for Sustainable Development of Marine Fisheries, Ministry of Agriculture, Key Laboratory for Fishery Resources and Eco-Environment, Shandong Province, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071 ;
3. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071
磷虾隶属于节肢动物门(Arthropoda)、甲壳动物纲(Crustacea)、磷虾目(Euphausiacea),是南大洋海洋浮游动物中一个重要类群(Everson,2000)。南极的磷虾种类多达11种,其中南极大磷虾(Euphausia superba Dana)数量最多且个体最大,即我们平常所称的南极磷虾(Euphausia superba)。南极磷虾不仅作为南大洋最大的单种生物资源,支撑企鹅、海豹、鲸类等庞大的高层捕食者的种群(王荣等,1995),而且是世界上生物量最大的可捕海洋生物资源之一(Everson,2000; Nicol et al,1997)。据估算南极磷虾的生物量为6.5- 10.0亿t(Roger et al,2000),最新研究结果为3.79亿t(Atkinson et al,2009)。由于其本身巨大的生物量和潜在的商业开发价值(黄洪亮等,2007; 苏学锋等,2012; 张吉昌等,2012),日益受到世界各国的关注。我国于2009年末正式启动了磷虾资源的实质性探捕和研究,逐步成为南极磷虾的主要捕捞国之一(左涛等,2012; 陈森等,2013)。
南极磷虾营养丰富而全面,蛋白含量(干样)高达的60%-65%,富含8种人体必需氨基酸且比例适宜,是一种优质动物性蛋白质源(Tou et al,2007;孙雷等,2008;刘丽等,2010)。此外,南极磷虾的脂类营养物质含量也十分丰富,含量占湿重的1%-6%(Fricke et al,1984)。从南极磷虾中提取的磷虾油富含不饱和脂肪酸,含量约占总脂肪酸含量的49.1%-67.6%,其中EPA和DHA在不饱和脂肪酸中所占的比例为79.1%-89.2%,这些指标均高于EPA和DHA含量在15%左右的普通鱼油(王南平等,2012);磷脂的含量约占磷虾油脂总量的40%(Bottino et al,1975);此外南极磷虾体内富含高抗氧化活性的虾青素,每100 g磷虾油中含有3-4 mg虾青素(Yamaguchi et al,1983)。目前,南极磷虾除具有较高的食用价值之外,主要用于提取附加值极高的磷虾油,而提取虾油之后的虾肉与虾壳的混合物,还可作为大马哈鱼等高档养殖鱼类的饲料,用于提高这些鱼类肌肉的色泽并促进生长(王南平等,2012)。
脂肪与蛋白含量对于磷虾油的提取与饲料品质至关重要,直接影响着磷虾渔业的经济效益。Saether等(1986)的研究表明,随着季节变化,南极磷虾的脂肪含量也随之变化,其干样中脂肪含量的范围为12%-50%;Meyer等(2010)的研究还表明,在食物缺少的冬季,除了脂肪作为主要能源物质,蛋白质也被中度利用。因此探究南极磷虾脂肪与蛋白含量的季节变化规律有利于实现南极磷虾的综合利用。
索氏抽提法是公认的脂肪含量测定的经典方法(韦方三等,2011)。脂肪含量测定中最关键的一步是脂肪的提取。目前南极磷虾脂肪的提取主要采用溶剂萃取法,所用溶剂包括乙醇、丙酮、石油醚、正己烷、环己烷、乙酸乙酯等毒性较低的有机溶剂(孙甜甜等,2012)。本研究首先对无水乙醇、丙酮、石油醚、正己烷、环己烷、乙酸乙酯6种常见溶剂的脂肪萃取效果进行了比较筛选,并在此基础上测定南极磷虾脂肪含量和蛋白含量,此外还分析了脂肪含量和蛋白含量的季节变化规律以及与体长的关系,以期为南极磷虾生产的优化配置提供参考、为南极磷虾生理生态学研究提供基础资料。
1 材料与方法 1.1 样品采集与保存实验样品为搭载中国渔轮“福荣海”,于2013年7-8月和2013年12月-2014年5月在南大洋南乔治亚群岛附近水域和南设得兰群岛附近水域采集所获。取样工具为磷虾中层拖网,囊网网目尺寸为2.0 cm。从渔获物中随机抽取磷虾样品200-500 g,放入密封袋中于船上冷库保存,其后以冷冻方式运至陆地实验室,并贮藏于-25℃冰柜中暂存。
2013年7-8月采集于南乔治亚群岛附近水域的磷虾样品来自岛屿的北部(图 1,右),体长范围为27- 63 mm;2013年12月-2014年5月采集于南设得兰群岛附近水域的样品来自6个站位(图 1,右),分别取自每月的15日左右,体长范围为29-68 mm。

|
图 1 2013年7-8月和2013年12月-2014年5月分别在南乔治亚群岛和南设得兰群岛附近水域的调查区域(左)及南设得兰群岛附近水域的样品采集站位分布(右图)。“▲”代表站位 Figure 1 (Left)survey areas for Antarctic krill in the waters nearby the South Georgia Islands from June to August in 2013 and the South Shetland Islands from December 2013 to May 2014;(Right)distribution of the sampling stations nearby the South Shetland Islands “▲” denoted sampling stations |
实验中使用的主要仪器、设备包括:DGX-9003鼓风干燥箱;电热恒温水浴锅;ALC-210.4型电子分析天平;索式抽提装置;全自动凯氏定氮仪Kjeldahl 2300;Tecator Digestor Auto 20消化炉。
主要试剂包括:无水乙醇(AR)、丙酮(AR)、石油醚(AR)、正己烷(AR)、乙酸乙酯(AR)、环己烷(AR)浓硫酸(AR)、硼酸(AR)、甲基红(AR)、溴甲酚绿(AR)、氢氧化钠(AR)、95%乙醇(AR)、无水碳酸钠(AR)、盐酸(AR)。
1.3 样品预处理将冷冻虾样取出后,解冻。采用常压烘干法,恒温(70℃)烘干至恒重,测得水分含量;然后用粉碎机将烘干好的样品粉碎、磨细、混匀,且保证每个干燥后样本重量达10 g以上,分别装入密封袋中,置于-25℃的冰箱中暂存,供后续脂肪与蛋白含量测定之用。
从2013年7-8月采集于南乔治亚群岛附近水域的样品中随机选取其中的20个样品,分别用无水乙醇、丙酮、石油醚、正己烷、乙酸乙酯、环己烷6种常见的有机溶剂作为萃取溶剂,采用索氏抽提法测定每个南极磷虾样品的脂肪含量,根据提取的脂肪含量以及提取过程中是否出现不溶物质以及溶剂毒性等,筛选能够稳定有效地提取南极磷虾脂肪的适宜溶剂。
用于分析脂肪和蛋白含量与体长关系的南极磷虾亦采用2013年7-8月采集于南乔治亚群岛附近水域的南极磷虾样品,干燥前先进行体长分组,根据样品的体长范围以及采集的样品量将样品分为小于40 mm、40-45 mm、46-50 mm以及50 mm以上4个体长组,每个体长组20个样本,共80个样本。体长以全长(TL,mm)为准,即额角前端至尾节末端的长度(Kirkwood et al,1982)。
2013年12月-2014年5月采集于南设得兰群岛附近水域的样品,每30 d采集了5个样本,共30个样品,主要用于分析脂肪和蛋白含量的季节变化。
1.4 脂肪含量与蛋白含量的测定采用索氏抽提法(GB/T 5009.6-2003)测定样品的脂肪含量,萃取溶剂采用筛选所得最适宜的溶剂,每个样品测定两次,测定结果相差超过0.5%,则测第3次;取差值在0.5%以内的两测定值的平均值为测定结果。采用微量凯氏定氮法(GB/T 5009.5-2010)测定样品的总氮含量,再乘以6.25得蛋白质的含量(张波等,2008)。结果保留两位有效数字。
脂肪含量计算公式如下:
| $F = \frac{{{m_1} - {m_2}}}{{{m_1} - m}} \times 100\% $ |
式中,F为脂肪占干重百分比,m为干燥至恒重的滤纸重,m1为装有样品的滤纸包重,m2为抽提后干燥至恒重的滤纸包重。
蛋白质含量计算公式如下:
| $P = \frac{{({v_1} - {v_0}) \times c \times 0.014}}{m} \times 6.25 \times 100\% $ |
式中,P为蛋白占干重的百分比,v1为样品消耗盐酸标准滴定液的体积,v0为试剂空白消耗盐酸标准滴定液的体积,c为盐酸标准滴定溶液浓度,m为取样重,6.25为氮换算为蛋白质的系数,0.014为1 ml盐酸标准滴定溶液相当的氮的质量。
1.5 数据处理与分析所有统计分析均以SPSS®(V.16.0)统计软件进行,对于采用不同溶剂测定的南极磷虾的脂肪含量、不同体长组、月份间的脂肪、蛋白质含量采用单因素方差分析(One-way ANOVE),数据差异显著时采用Duncan氏法进行多重比较,显著水平为P<0.05;对不同月份间南极磷虾脂肪与蛋白含量关系以Pearson相关性进行分析,以P<0.05作为显著相关的标志。
所得实验数据结果均用平均值±标准误(Mean± SE)表示。
2 结果 2.1 不同溶剂南极磷虾脂肪的提取效果图 2给出了以不同溶剂作为萃取剂测定的南极磷虾脂肪含量。从图 2中可以看出,不同溶剂的测定结果从高到低依次为无水乙醇(22.03±0.19)、丙酮(14.26± 0.22)、乙酸乙酯(13.62±0.22)、环己烷(13.01±0.24)、正己烷(12.68±0.21)、石油醚(12.08±0.10),检验结果显示,除正己烷与环己烷的测定结果不存在显著性差异外(P>0.05),其他各组间均存在显著性差异(P<0.05);其中用正己烷与环己烷萃取过程中出现过乳状不溶物。无水乙醇的萃取效果(测定的脂肪含量)显著高于其他5种萃取溶剂,且在实验过程中没有出现胶溶现象;抽提后含有南极磷虾脂质的提取液颜色呈橙红色,较其他溶剂所获提取物颜色更深、更清澈。

|
图 2 不同溶剂测定的南极磷虾的脂肪含量 Figure 2 Lipid content of Antarctic krill measured using different solvents 数据上标字母不同表示显著性差异(P<0.05) Date with different letters were significantly different(P<0.05) |
表 1显示了不同体长组的南极磷虾脂肪含量(溶剂为无水乙醇)和蛋白含量。
|
|
表 1 2013 年7−8 月南乔治亚群岛附近海域不同体长组南极磷虾干样的脂肪与蛋白含量 Table 1 Contents of lipids and proteins of Antarctic krill in different body length groups from the water adjacent to the South Georgia Islands from July to August 2013 (% dry matter) |
检验结果显示,40 mm以下的体长组南极磷虾脂肪与蛋白含量均显著高于40 mm以上的体长组(P<0.05);40-45 mm与46-50 mm组以及46-50 mm与50 mm以上的体长组之间,脂肪与蛋白含量均无显著性差异(P>0.05);50 mm以上体长组的脂肪含量显著高于40-45 mm体长组,而前者的蛋白含量则显著低于后者,尽管差异幅度均较小。
单从均值来看(表 1),40 mm以上体长组的磷虾随体长的增长其脂肪含量有增加、蛋白含量有降低的趋势。
2.3 南极磷虾脂肪含量与蛋白含量的季节变化表 2列示了2013年7-8月南乔治亚群岛附近海域和2013年12月-2014年5月南设得兰群岛附近海域南极磷虾的脂肪与蛋白含量测定结果。南设得兰群岛附近海域南极磷虾脂肪含量的变化范围为19.83%- 30.58%,最低值出现在初夏12月,为(19.83±0.04)%;最高值出现在秋季4月,为(30.58±0.02)%。冬季7-8月南乔治亚群岛附近海域磷虾的脂肪含量为(22.03± 0.51)%,明显高于初夏12月的含量。
|
|
表 2 2013年7-8月和2013年12月-2014年5月南乔治亚群岛海域(CCAMLR统计亚区48.3)和南设得兰群岛海域(CCAMLR统计亚区48.1)各月份南极磷虾干样的脂肪与蛋白含量 Table 2 Contents of lipids and proteins of Antarctic krill from the South Georgia Islands(CCAMLR statistical subarea 48.3)between July and August 2013 and from the South Shetland Islands(CCAMLR statistical subarea 48.3)between December 2013 and May 2014(% dry matter) |
如图 3所示,南极磷虾蛋白含量与脂肪含量的季节变化趋势恰好相反,初夏12月最高,为(66.75±0.14)%;秋季4月最低,为(58.02±0.23)%。脂肪与蛋白含量均呈显著负相关(P=0.005,r=-0.905)。
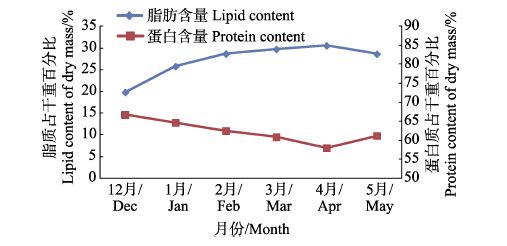
|
图 3 2013年12月-2014年5月南设得兰群岛海域南极磷虾干样的脂肪与蛋白质含量季节变化 Figure 3 Seasonal variations in the contents of lipids and proteins of Antarctic krill in the water adjacent to the South Shetland Islands from December 2013 to May 2014(% dry matter) |
南极磷虾由于处于南极低温、严酷的生态环境和独特的生活方式使其具有产生新型生物活性物质的巨大潜力。作为南极特有的生物,南极磷虾的磷脂水平达到其总脂的30%以上(娄乔明等,2011、2012),因而用不同提取溶剂测定的含量亦不尽相同。对于提取虾类(包括南极磷虾)脂肪适宜溶剂的选择,近几年也有不少研究,溶剂选择包括氯仿甲醇(孙甜甜等,2012)、正己烷(周如金等,2008)、环己烷(张立彦等,2004)、正己烷+乙酸乙酯(崔秀明等,2011)、无水乙醇(赵传凯等,2012)等。本研究进一步验证了无水乙醇是提取南极磷虾脂类的适宜溶剂。研究过程中石油醚、正己烷、环己烷等非极性溶剂的脂肪测定值均较低且易发生乳化现象,而丙酮毒性较大。此外,常用作实验室测定脂肪含量的石油醚、乙醚以及常规作为定量测定水产品脂肪含量的氯仿/甲醇三种溶剂中,石油醚做提取剂时脂肪量明显偏低;乙醚与氯仿作为二级禁药,易燃易爆且有毒;而乙醚易被2%的水饱和,使测定值偏低。除脂肪提取效果较好外(图 2),无水乙醇的价格相对便宜,安全性更高,残溶对人身体健康影响较小,因此无水乙醇更适合实验室测定南极磷虾脂肪含量。
3.2 南极磷虾脂肪含量和蛋白含量与体长的关系根据Meyer等(2010)和左涛等(2012)对南极磷虾捕捞群体年龄与体长的相关描述,体长小于40 mm组的南极磷虾主要属于未成体与次成体(1+/2+),40-45 mm、46-50 mm以及体长大于50 mm组的南极磷虾则属于成体或高龄群体。分析结果显示,全长小于40 mm的未成体与次成体磷虾个体的脂肪与蛋白含量均显著高于全长大于40 mm的成体或高龄群体(P<0.05);全长大于40 m m的成体间不同体长组脂肪与蛋白含量均变化不大,脂肪与蛋白含量分别在21%、63%左右。南极磷虾幼体经历3个阶段9个发育期,雄22个月、雌25个月可达到性成熟。南极磷虾的主要产卵季节为1-3月、或更长的12月-翌年4月,夏末出现了早期蚤状幼体,然后经过越冬与蜕皮,在第2年夏季来临之前发育为未成体。第2年在食物丰盛的夏秋季节,未成体与次成体体内脂肪明显 增加,以能很好地度过漫长的冬季并发育为成体(Hagen et al,2001)。
3.3 南极磷虾脂肪和蛋白含量的季节变化南大洋水温的季节变化不大(表 2),南极磷虾生化成分季节变化主要由于南大洋高纬度短暂的光照周期与冬季广泛的海冰覆盖限制了初级生产力,从而限制了南极磷虾的食物来源。在饵料严重缺乏的冬季,南极磷虾似乎主要通过3种途径予以适应,(1)夏秋季储存大量脂肪为越冬提供能量;(2)摄食属性由浮游植物转化为杂食性;(3)某些生理机能如呼吸频率、摄食率等的降低(Marschall et al,1988; Quetin et al,1991; Huntley et al,1994; Hagen et al,2001; Meyer et al,2011)。本研究表明,从春末(12月)到秋末(5月),南设得兰群岛附近水域的南极磷虾脂肪含量基本呈现上升趋势,并在4月达最大值30.6%,然后在5月有所下降,表明该阶段南极磷虾脂肪的连续性累积;南乔治亚群岛附近水域冬季7-8月南极磷虾脂肪含量仍处于较高水平,达22.0%,高于12月南设得兰群岛水域南极磷虾脂肪含量,表明经过冬季消耗,脂肪含量在春季达到最低。
如表 3所示,Meyer等(2010)的研究表明,拉扎列夫海的南极磷虾成体的脂肪含量(占干重百分比),春季(5.2%)显著低于秋季(31.9%)与冬季(29.6%),秋季最高,冬季仍处于较高水平。Hagen等(2001)的研究表明,维德尔海南极磷虾总脂含量从晚冬或早春的极低水平(10-11月,10%)经过夏季积累(1-2月,28%)在秋季达到最大值(4-5月,40%以上);该研究同时显示拉扎列夫海与南极半岛海域有类似变化趋势,拉扎列夫海冬季磷虾脂肪含量同样维持在一个较高水平,南极半岛海域夏季早期仅比冬春之交的脂肪含量略有增长。以上研究与本研究显示了相同的趋势。Hagen等(2001)的研究还表明,在秋季中期或末期(4、5月)到春季中期或末期(10、11月)维德尔海和拉扎列夫海南极磷虾的脂肪含量减少了70%;其中指示脂肪分解的代谢酶3-羟酰辅酶A脱氢酶(HOAD),冬季是晚春和秋季的5倍左右,表明脂肪在冬季被大量利用;秋季(4月)南极磷虾的O:N比为15,表明秋季没有利用体内储存的脂肪(Atkinson et al,2002);冬季(7、8月)南极磷虾的O:N比为66,表明该阶段磷虾体内的脂肪被充分利用(Ikeda et al,2000),从而使脂肪含量直线下降,在春季达到最小值。
|
|
表 3 不同海区与季节的南极磷虾脂肪含量 Table 3 Lipid content of Antarctic krill from different locations and seasons(% dry matter) |
与脂肪含量的变化相比,12月-翌年5月南极磷虾蛋白含量的相对变化要缓和的多,范围为57%-67%,基本维持在58%以上。同样,扎列夫海域同样大小的南极磷虾2005年春末(12月)与2006年冬季(7月)的蛋白含量仅相差0.6%,表明越冬过程中蛋白几乎没有被利用(Meyer et al,2010)。Torres等(1994)的研究也得出类似结论,相较于脂肪几近耗尽,南设得兰-威德尔海海域3-8月蛋白含量仅减少了16%。Anger(2001)通过研究不同季节N与蛋白的关系表明,越冬过程中仅有少量蛋白被利用,大部分N元素稳定存在于肌肉蛋白中。
以上分析显示,南极磷虾脂肪含量的季节变化剧烈程度要比蛋白含量的季节变化程度大的多,当磷虾渔获主要用于生产南极磷虾油等高值产品时,应充分考虑南极磷虾脂肪含量的季节变化,以提高磷虾产业的整体效益。
| 王南平, 何兰, 曹俊, 等. 南极磷虾的特性和利用. 水产科技情报 , 2012, 40 (3) : 128-131 | |
| 王荣, 孙松. 南极磷虾渔业现状与展望. 海洋科学 , 1995 (4) : 28-32 | |
| 韦芳三, 李纯厚, 戴明, 等. 索氏提取法测定海洋微藻粗脂肪含量及其优化方法的研究. 上海海洋大学学报 , 2011, 20 (4) : 619-623 | |
| 田晓清, 杨桥, 邵盛男, 等. 南极磷虾脂溶性成分的研究进展. 海洋渔业 , 2011, 33 (4) : 462-466 | |
| 左涛, 赵宪勇, 黄洪亮, 等. 南极半岛邻近水域南极大磷虾商业捕捞群体的年龄结构时空变化. 渔业科学进展 , 2012, 33 (4) : 1-10 | |
| 刘志东, 陈雪忠, 黄洪亮, 等. 南极磷虾粉的营养成分分析及评价. 中国海洋药物杂志 , 2012, 31 (2) : 43-48 | |
| 刘丽, 刘承初, 赵勇, 等. 南极磷虾的营养保健功效以及食用安全性评价. 食品科学 , 2010, 31 (17) : 443-447 | |
| 孙雷, 周德庆, 盛晓风. 南极磷虾营养评价与安全性研究. 海洋水产研究 , 2008, 29 (2) : 57-64 | |
| 孙甜甜, 薛长湖, 薛勇, 等. 南极磷虾脂质提取方法的比较. 食品工业科技 , 2012, 33 (16) : 115-121 | |
| 陈森, 赵宪勇, 左涛, 等. 南极磷虾渔业监管体系浅析. 中国渔业经济 , 2013, 31 (3) : 75-83 | |
| 苏学锋, 冯迪娜. 南极磷虾产业开发特点及发展趋势. 食品研究与开发 , 2012, 33 (12) : 214-217 | |
| 张立彦, 王琨, 曾庆孝. 虾头中脂溶性成分的提取研究. 武汉工业学院学报 , 2004, 23 (4) : 5-9 | |
| 张波, 张敏, 戴芳群, 等. 黄海中南部16种重要生物资源种类的生化组成及能量含量. 海洋水产研究 , 2008, 29 (5) : 11-18 | |
| 张吉昌, 赵宪勇, 王新良, 等. 商业探鱼仪南极磷虾声学图像的数值化处理. 渔业科学进展 , 2012, 33 (4) : 64-71 | |
| 赵传凯, 姜国良, 赵静, 等. 南极大磷虾油脂的提取及其脂肪酸组成分析. 食品工业科技 , 2012, 33 (3) : 207-209 | |
| 周如金, 赵顺珠, 黄晓梅, 等. 虾头油提取工艺研究. 中国油脂 , 2008, 33 (5) : 77-79 | |
| 娄桥明, 王玉明, 刘小芳, 等. 南极磷虾脂肪酸组成及多不饱和脂肪酸质谱特征分析. 中国水产科学 , 2011, 18 (4) : 929-935 | |
| 娄桥明, 王玉明, 杨文鸽, 等. 南极磷虾粉脂质及脂肪酸组成分析. 水产学报 , 2012, 36 (8) : 1256-1262 | |
| 黄洪亮, 陈雪忠, 冯春雷. 南极磷虾资源开发现状分析. 渔业现代化 , 2007, 34 (1) : 48-51 | |
| 崔秀明, 汪之和, 施文正. 南极磷虾粗虾油提取工艺优化. 食品科学 , 2011, 32 (24) : 126-129 | |
| Anger K. Chemical composition. In: Vonk R (ed) The biology of decapod crustacean larvae (Crustacean Issues 14). Rotterdam. Balkema Publishers , 2001 : 183-211 | |
| Atkinson A, Meyer B, Stübing D, et al. Feeding and energy budgets of Antarctic krill Euphausia superba at the onset of winter. II. Juveniles and adults. Limnol Oceanogr , 2002, 47 (4) : 953-966 | |
| Atkinson A, Siegel V, Pakhomov EA, et al. A re-appraisal of the total biomass and annual production of Antarctic krill. Deep Sea Res PT I , 2009, 56 (5) : 727-740 DOI:10.1016/j.dsr.2008.12.007 | |
| Bottino NR. Lipid composition of two species of Antarctic krill: Euphausia superba and E. crystallorophias. crystallorophias. Comp Biochem Physiol B , 1975, 50 (3) : 479-484 | |
| Everson, I .. Krill: biology, ecology and fisheries. Oxford: Blackwell Science , 2000 | |
| Frazer TK, Quetin LB, Ross RM. Energetic demands of larval krill, Euphausia superba, in winter. J Exp Mar Biol Ecol , 2002, 277 (2) : 157-171 DOI:10.1016/S0022-0981(02)00328-3 | |
| Fricke H, Gercken G, Schreiber W, et al. Lipid, sterol and fatty acid composition of antarctic kril (Euphausia superba Dana) Lipids. , 1984, 19 (11) : 821-827 | |
| Gigliotti JC, Davenport MP, Beamer SK, et al. Extraction and characterization of lipids from Antarctic krill (Euphausia superba). Food Chem , 2011, 125 (3) : 1028-1036 DOI:10.1016/j.foodchem.2010.10.013 | |
| Hagen W, Kattner G, Terbrüggen A, et al. Lipid metabolism of the Antarctic krill Euphausia superba and its ecological implications. Mar Biol , 2001, 139 (1) : 95-104 DOI:10.1007/s002270000527 | |
| Huntley ME, Nordhausen W, Lopez MDG. Elemental composition, metabolic activity and growth of Antarctic krill Euphausiasuperbaduring winter. Mar Ecol-Prog Ser , 1994, 107 (1-2) : 23-40 | |
| Ikeda T, Torres JJ, Hernandez LS, et al. Metabolism. In: Harris RP, Wiebe PH, Lenz J, et al (eds) ICES zooplankton methodology manual. London: Academic Press , 2000 : 455-532 | |
| Janet CT, Jacek J, Chen YC. Krill for human consumption: nutritional value and potential health benefits. Nutrition Reviews , 2007, 65 (2) : 63-77 | |
| Kirkwood JM. A guide to the Euphausiacea of the Southern Ocean. ANARE Res Notes 1 , 1982 : 1-45 | |
| Marschall HP. The overwintering strategy of Antarctic krill under the pack-ice of the Weddell Sea. Polar Biol , 1988, 9 (2) : 129-135 DOI:10.1007/BF00442041 | |
| Meyer B, Auerswald L, Siegel V, et al. Seasonal variation in body composition, metabolic activity, feeding, and growth of adult krill Euphausia superba in the Lazarev Sea. Mar Ecol Prog Ser , 2010, 398 (12) : 1-18 | |
| Meyer B. The overwintering of Antarctic krill, Euphausia superba, from an ecophysiological perspective. Polar Biol , 2012, 35 (1) : 15-37 DOI:10.1007/s00300-011-1120-0 | |
| Nicol S, Endo Y. Krill fisheries of the world. Rome: Food and Agriculture Organization of the United Nations , 1997 | |
| Phleger CF, Nelson MM, Mooney BD, et al. Interannual and between species comparison of the lipids, fatty acids and sterols of Antarctic krill from the US AMLR Elephant Island survey area. Comp Biochem and Phys B , 2002, 131 (4) : 733-747 DOI:10.1016/S1096-4959(02)00021-0 | |
| Putland J, Sutton TT. Survey of larval Euphausia superba lipid content along the Western Antarctic Peninsula during late autumn 2006. Polar Sci , 2011, 5 (3) : 383-389 DOI:10.1016/j.polar.2011.01.001 | |
| Quetin LB, Ross RM. Behavioural and physiological characteristics of the Antarctic krill, Euphausia superba. Integr Comp Biol , 1991, 31 (1) : 49-63 | |
| Roger PH, Elizabeth HL, Linen L. The fishery on Antarctic krill: Defining an ecosystem approach to management. Rev Fish Sci , 2000, 8 (3) : 235-298 DOI:10.1080/10641260091129224 | |
| Ross RM, Quetin LB. Energetic cost to develop the first feeding stage of Euphausia superba Dana and the effect of delays in food availability. J Exp Mar Biol Ecol , 1989, 133 (1-2) : 103-127 DOI:10.1016/0022-0981(89)90161-5 | |
| Saether O, Ellingsen TE, Mohr V. Lipids of north Atlantic krill. J Lipid Res , 1986, 27 (3) : 274-285 | |
| Siegel V. Age and growth of Antarctic Euphausiacea (Crustacea) under natural conditions. Mar Biol , 1987, 9 (4) : 483-495 | |
| Siegel V, Kalinowski J. Krill demography and small-scale processes: a review. In: EI-Sayed SZ(ed): Southern Ocean ecology: the BIOMASS perspective. Cambrige: Cambridge University Press. 1994, 145-163 | |
| Torres JJ, Donnelly J, Hopkins TL, et al. Proximate composition and overwintering strategies of Antarctic micronektonic Crustacea. Mar Ecol-Prog Ser , 1994, 113 (3) : 221-232 | |
| Tou JC, Jaczynski J, Chen YC. Krill for human consumption: nutritional value and potential health benefits. Nutr Rev , 2007, 65 (2) : 63-77 | |
| Yamaguchi K, Miki W, Toriu N, et al. The composition of carotenoid pigments in the Antarctic Krill Euphausia superba.. Bulletin of the Japanese Society of Scientific Fisheries , 1983, 49 (9) : 1411-1415 DOI:10.2331/suisan.49.1411 |



