2. 农业部海洋渔业可持续发展重点实验室 中国水产科学研究院黄海水产研究所 青岛 266071;
3. 莱州明波水产有限公司 烟台 261418
2. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071 ;
3. Laizhou Mingbo Aquatic Co. Ltd, Yantai 261418
染色体是细胞内遗传信息的载体,不同的物种都具有各自特定数目和形态结构的染色体,其不仅代表了物种的特有性特征,在一定程度上还可反映生物的进化历程。物种在进化过程中所发生的遗传物质的变化,常表现为染色体数目和类型的变化。鱼类染色体及核型分析研究是鱼类细胞遗传学的主要内容之一,在分类学上对探索鱼类亲缘关系、分化过程等方面具有重要意义,而且在现代遗传学中的基因定位、杂交以及多倍体育种等领域也起着日益重要的作用。我国鱼类染色体已有的研究主要集中在淡水种类,有关海水鱼类染色体的研究近年来才得到重视(余先觉等, 1989; 楼允东, 1997; 王梅林等, 2000; 赵金良等, 2000)。
鱼类染色体制备一般采用直接法,经过植物血凝素(PHA)、秋水仙素、低渗处理后,滴片获得(王世锋等, 2003; 张伟明等, 2003; Ojima et al, 1966),由于获取的组织材料及处理方法的差异,得到的细胞分裂中期相的数量和质量也不相同。研究经常有特殊的情况和目的,如研究材料珍贵必须保留活体、鱼苗种质跟踪鉴定、野外快速取材等(Rivlin et al, 1985),因此,探究在不同情况下制备鱼类染色体的最佳方法是非常有必要的。
鞍带石斑鱼(Epinephelus lanceolatus)俗称龙趸、龙胆石斑鱼,棕点石斑鱼(Epinephelus fuscoguttatus)又称褐点石斑鱼,俗称老虎斑、虎头斑,它们在分类学上均属于鲈形目(Perciformes),鲈亚目(Percoidei),鳍科(Serranidae),石斑鱼亚科(Epinephelinae),石斑鱼属(Epinephelus),为海洋暖水性岛礁栖鱼类,是我国重要的海水养殖名贵品种,它们肉味鲜美,营养丰富,市场潜力巨大,深受广大消费者的青睐(Heemstra et al, 1993; 成庆泰等, 1987; 张海发等, 2008)。珍珠龙胆又称龙虎斑,是以鞍带石斑鱼为父本、褐点石斑鱼为母本进行杂交的子代新品种,因其体表具有鲜艳的体色和形似珍珠的斑点而得名。通过杂交,珍珠龙胆获得了父本的生长速度快和母本的抗病能力强两方面的杂种优势,具有较高的养殖、食用和观赏价值,成为养殖和市场开发的优良品种,消费前景广阔(李样红等, 2013; 符书源等, 20111))。
石斑鱼已成为重要的海洋水产养殖对象,目前对石斑鱼的研究多集中在人工繁育、养殖和疾病防控技术等方面,在细胞遗传学方面缺乏系统的研究与报道。珍珠龙胆作为杂交种,养殖历史较短,至今尚未见到有关其染色体的研究报道。本研究总结了两种染色体制备方法在珍珠龙胆的不同组织上的效果,丰富了鱼类染色体的制备方法,并为不同情况下快速选择有效、适宜的研究策略提供参考;同时分析其染色体的制备方法及染色体核型,以期为鱼类杂交新品种选育和鉴定技术提供重要的参考依据。
1 材料与方法 1.1 材料2014年6月取自莱州明波水产有限公司的珍珠龙胆幼鱼(图 1)共17尾,规格为:体重18–25 g,体长8–12 cm。

|
图 1 珍珠龙胆(鞍带石斑鱼为父本、褐点石斑鱼为母本的杂交子一代) Figure 1 Hybrid F1 (E. fuscoguttatus♀×E. lanceolatus♂) |
在预实验中,使用活体注射法和幼鱼游泳法对珍珠龙胆和赤点石斑鱼(Epinephelus akaara) 2种石斑鱼进行染色体制备,通过对制备效果的初步分析比较,决定对体型较小的珍珠龙胆幼鱼选用幼鱼游泳法。热滴片法的选择则依据对2种石斑鱼冷热滴片方法获得的比较结果(表 1)。
|
|
表 1 不同实验材料制备石斑鱼染色体细胞分裂指数比较 Table 1 Comparison of mitotic indices of chromosomes prepared with different materials from groupers |
将珍珠龙胆幼鱼放在秋水仙素浓度为0.015%的自然海水中游泳3–5 h,用小剪刀分别取鱼苗背鳍和尾鳍尖部,置于5 ml的离心管中。
1.2.2 低渗加入约4 ml 0.075 mol/L的KCl低渗液,30℃处理25 min。
1.2.3 固定低渗处理后2200 r/min离心5 min,去上清液,留底部约1 ml沉淀,加入4 ml卡诺氏固定液(甲醇:冰醋酸=3:1),用吸管慢慢吹打沉淀至充分混匀,固定20 min后2200 r/min离心5 min,弃上清液,留底部约1 ml,加4 ml固定液,固定,离心,反复两次。
1.2.4 解离第3次固定后弃上清液,加解离液(50%冰醋酸)至约3 ml进行解离,期间每隔5 min轻轻吹打1次。
1.2.5 滴片解离后留底部约2 ml沉淀,滴片前轻轻弹打离心管底部。分别采用热滴片法和冷滴片法进行滴片。热滴片,将清洁干净的玻片放在50℃的培养箱中预热30 min以上,每次取出2张玻片进行滴片,于约1 m的高处滴到载玻片上,每片滴1–2滴,自然风干;冷滴片,用冰块将解剖盘铺平,表面铺上1层保鲜薄膜,将处理干净的载玻片置于上面,从1 m高处滴片,每片1–2滴,液体自然风干。
1.2.6 染色待玻片完全干燥后,用10%的Giemsa染液染色30 min后用蒸馏水冲洗干净并晾干,显微镜下观察并拍照。
1.3 观察与统计在显微镜100倍油镜下随机统计30个视野,计算细胞有丝分裂指数。有丝分裂指数=分裂相/细胞总数×100%。选取75个分散良好的细胞,用Olympus显微镜进行观察统计,确定染色体2n数目。
1.4 核型分析选取10个数目完整、分散效果良好、长度适中(正中期)、着丝点清楚、两条染色单体适度分开、形态清晰的染色体分裂相进行显微拍照,绘制染色体模式图。对图像上的染色体计数后,沿边缘剪下染色体进行编号;再初步目测配对、分组;分别测量其长度,计算相对长度、着丝点指数、臂比,对相同的染色体间配对(着丝点类型相同、相对长度相近的一组染色体按长短排队,短臂向上),再将配对好的染色体分类、排列其组型。
染色体相对长度=每条染色体长度/染色体组总长×100
臂指数=长臂长度/短臂长度
按Levan等(1964)提出的标准划分亚中部和端部着丝粒染色体。臂指数在1.0–1.7之间,为中部着丝粒染色体(m),在1.7–3.0之间为亚中部着丝粒染色体(sm),在3.0–7.0之间为亚端部着丝粒染色体(st),在7.0以上为端部着丝粒染色体(t)。染色体臂数(NF),根据着丝粒来确定,端部着丝粒染色体(t),NF=1;中部、亚中部和亚端部着丝粒染色体(m、sm、st),NF=2。
2 结果与分析 2.1 染色体细胞分裂指数比较运用上述两种方法均能获得形态良好的珍珠龙胆石斑鱼染色体分裂相。随机统计30个视野中细胞总数及有丝分裂指数,结果见表 1。有丝分裂指数=细胞分裂中期相数/细胞总数×100%。
2.2 染色体数目选取不同个体、分散良好、形态清晰、数目完整的75个珍珠龙胆细胞的染色体中期分裂相,经观察统计得出,珍珠龙胆染色体众数为48,众数出现频率为81.33%(表 2、表 3),结果显示,其二倍体染色体数目为48。
|
|
表 2 珍珠龙胆石斑鱼中期分裂相 Table 2 Counts of the chromosomes in cells of hybrid F1 groupers |
|
|
表 3 珍珠龙胆的染色体相对长度和臂比 Table 3 The chromosomal metaphase of hybrid F1 groupers |
分别对10个中期分裂相(图 2)进行镜检和测量,统计染色体的相对长度、臂比以及染色体类型(表 3)。根据染色体的相对长度、着丝点位置和特征,珍珠龙胆的48条染色体中有2对亚端部着丝点染色体(st),22对端部着丝点染色体(t),核型公式为2n=48,4st+44t,NF=52,其核型各项参数见表 3,染色体组型见图 3。
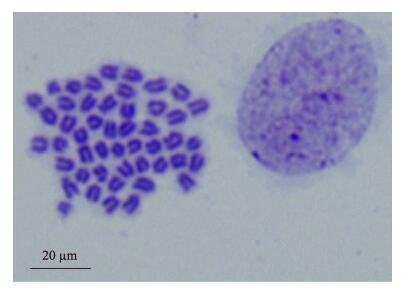
|
图 2 珍珠龙胆石斑鱼中期分裂相 Figure 2 The chromosomal metaphase of hybrid F1 groupers |

|
图 3 珍珠龙胆石斑鱼染色体组型 Figure 3 The karyotype of hybrid F1 groupers |
无论是鱼类还是其他生物,获取生命活动旺盛、分裂增生较快的组织器官是制备染色体的基本前提,对成功获得染色体有决定意义(吴彪等, 2012)。珍珠龙胆石斑鱼通过杂交,获得了父本生长速度快和母本抗病能力强两方面的优势,其生长速度快的特性,表明了其生命活力更加旺盛,分裂能力较强。在选择鱼体材料时,根据实际实验条件和目的,选择适宜的组织部位和处理方法也同样重要。
目前,鱼类染色体制备所用的组织主要有头肾、鳍条、鳃丝、血液、胚胎等,如毛连菊等(2002)以脾脏、肾脏细胞及鳃组织细胞成功制备了5种常见海水鱼的染色体并对其组型进行分析;王云新等(2004)以头肾细胞为材料用常规方法对斜带石斑鱼(Epinephelus coioides)与赤点石斑鱼染色体核型进行了研究。鱼类的整个生长阶段,头肾细胞分裂都十分旺盛,但在染色体的制备过程中由于幼鱼头肾组织较小、实验操作难度大,很难获得所需数量的头肾细胞,此方法一般用于个体较大的成鱼。当选用鳍条为材料制备染色体时,由于体型较大的成鱼生长速度相对缓慢,其鳍条组织分裂不够旺盛,因此,取鳍条作为材料时选用个体较小、生长快速的仔稚幼鱼较为理想。本研究以实验室中现有的赤点石斑鱼成鱼和珍珠龙胆幼鱼为实验材料做了对比预实验,采用赤点石斑鱼成鱼头肾时,较易获得效果良好的染色体;使用鳍条时,片子中多为破碎的细胞杂质,没有观察到细胞中期分裂相。使用珍珠龙胆幼鱼作为材料实验时,只有鳍条获得了较好的染色体。预实验的结果与上述观点相同。
另外,预实验采用赤点石斑鱼成鱼头肾制备染色体时,采用热滴片法其分裂指数最高,达到9.56%,采用冷滴片法时为1.82%;而以珍珠龙胆幼鱼鳍条为材料制备的染色体,采用热滴片法时其分裂指数为2.58%,冷滴片法时为0.83%。谭杰等(2011)在制备海参染色体时所统计的海参不同发育阶段的细胞分裂指数也不同。造成这种分裂指数差别的原因可能是实验材料和处理方法存在差异所致。一般而言,用新陈代谢活动旺盛的部位制备染色体标本时相对简单,获得的细胞分裂指数也较高。因此制备染色体时选择合适的材料及相应的获取手段非常关键。
3.1.2 染色体的制备方法及其必要条件方法和条件是成功获得优良染色体的必要保障,PHA能够促进细胞增殖、秋水仙素可以使分裂的细胞停止在中期、空气干燥法可使染色体展开等,一系列技术的研究和发展大大促进了染色体制备技术的进步(周丽青等, 2005; 贾志良等, 2001; 林义浩等, 1982)。
吴彪等(2012)研究表明,对个体较大的成鱼使用活体注射法制备染色体时,进行PHA处理可明显促进鱼体细胞增殖,而在只注射秋水仙素的鱼肾组织中所获得的中期分裂相较少;个体较小的幼鱼生长速度快,细胞分裂旺盛,直接进行秋水仙素处理就可获得较高的染色体中期分裂相, 。王琼等(1994)提出秋水仙素处理会造成贻贝染色体收缩,且长臂与短臂不成比例地缩短, 秋水仙素处理时间过长,分裂细胞多,染色体短小,反之,则少而细长,都不宜观察形态和计数。同时,低渗的处理时间也是其中一个重要的影响因素。KCl低渗处理利用反渗透作用使细胞膨胀染色体分散,以便能在一个平面上观察所有染色体形态,如果低渗过度,则会引起细胞易破裂,造成染色体散失混乱,低渗不足则细胞不易摔裂,染色体叠加且不易分开。由于石斑鱼的品种及规格大小不同,其细胞的耐受力也存在差异,预实验中对低渗时间设计了20、25、30、35和40 min 5个梯度,最终确定赤点石斑鱼的有效低渗时间为35 min,珍珠龙胆为25 min,其他时间梯度中均无法获得良好的染色体分裂相。由此说明,正确掌握各种鱼类对PHA、秋水仙素、低渗液的处理时间和浓度,是获得数量较多、效果较好染色体中期分裂相的关键。
滴片时,温度是影响石斑鱼染色体制备的关键点,选用热滴片能够获得比冷滴片更好的染色体分散效果。此外,染色体制备过程中注意离心之前需要配平,离心速度过高,细胞团不易打散且易造成细胞破裂;反之,细胞沉淀不下来,易丢失。滴片高度不适,会造成染色体过于分散甚至断裂缺失,或者细胞不会破裂而得不到分裂相。
3.2 石斑鱼的核型分析 3.2.1 石斑鱼染色体核型的比较国内外研究显示,对石斑鱼的核型分析已有25种,国内最早有关石斑鱼核型的报道见于洪满贤等(1988)研究的青石斑鱼(Epinephelus awoara),从已报道文献和本研究结果看,石斑鱼染色体的数目均为2n=48,但不同种类的染色体形态存在一定程度的多样性(表 4)。
|
|
表 4 25种石斑鱼的核型特征比较 Table 4 Comparison of karyotypes of the related 25 species of groupers |
石斑鱼的同属、种间、甚至同种不同地理种群间的染色体存在显著多样性的现象时有发生。施立明(1996)研究表明,一个物种核型特征的稳定是相对的,种内染色体的多态是广泛存在的现象。这与石斑鱼生存环境的多样性及地域分布不同,出现的遗传分化有关。不同研究者的实验方法不同,测量染色体的时相不一致,测量和配组误差也会造成差异。廖经球等(2006)对褐点石斑鱼的核型进行研究,得到褐点石斑鱼的核型为2n=48,2sm+46t,NF=50;王德祥等(2003)对宽额鲈(鞍带石斑鱼)染色体核型进行研究,得到其染色体核型为2n=48,4st+44t,NF=50。虽然鞍带石斑鱼与棕点石斑鱼的染色体核型已有报道,但至今还未见有关其杂交后代珍珠龙胆的染色体核型的报道。
本研究揭示了珍珠龙胆与父本鞍带石斑鱼的核型基本一致(均为4st+44t),无显著差异,而与母本棕点石斑鱼核型(2sm+46t)存在很大差异,表明杂交后代与父本鞍带石斑鱼的遗传特性非常相似,通过微卫星分析杂交石斑鱼珍珠龙胆与亲本间的遗传距离,显示珍珠龙胆与父本鞍带石斑鱼的亲缘关系更近(周翰林等, 2012)。其快速生长的特性也证实了其遗传特性和特征。
3.2.2 染色体核型研究为其分类及种质鉴定提供依据目前,石斑鱼的分类主要还是依据其外部表型特征(如体色、体表条纹及斑点等),但石斑鱼的体色和斑纹极易随环境、年龄、生理等变化而发生改变,给石斑鱼的分类鉴定造成很大的困难。由于一个物种的核型特征,即染色体的数目和形态结构具有相对稳定性,因此,石斑鱼染色体核型的多样化能够为其系统分类、种质鉴定提供依据。
从表 4可以看出,点带石斑鱼(Epinephelus malabaricus)与青石斑鱼及黑边石斑鱼(Epinephelus fasciatus)的核型为2n=48,48t,NF=48,但它们的形态差异较大;同样,棕点石斑鱼与六带石斑鱼(Epinephelus sexfasciatus)、斜带石斑鱼核型相同,均为2n=48,2sm+46t,NF=50,它们的外部形态相差也较大。相反,外部形态相似的石斑鱼,其核型不一定相同。如七带石斑鱼(Epinephelus septemfasciatus)与褐石斑鱼(Epinephelus bruneus)外表形态特征相似,特别是在应激状态下,它们的体表横纹均会消失,难以根据外部形态特征来区分。但是,褐石斑鱼属于特化类群,有3对特征性的双臂染色体,而七带石斑鱼属于原始类群,染色体均为单臂染色体(表 4),通过染色体核型差异很容易将其区分。因此,可以通过染色体核型分析来辅助鱼类的分类鉴定,同时鱼类染色体的核型研究可为鱼类种质标准的评定提供证据。
3.3 石斑鱼的类群演化、新种形成与染色体的关系鱼类的演化程度与鱼本身细胞的染色体类型是一致的,而物种的核型演化主要通过染色体重组进行(王梅林等, 2000)。小岛吉雄(1979)探讨了鱼类的进化与染色体的关系,通过对大量资料的分析指出,高位类群鱼类在进化上处于上位,其染色体数目收敛,最高峰值为2n=48,M (m和sm)型染色体少,A (st和t)型染色体多。另外,李树深(1981)研究认为,在特定的分类阶元中,具有较多端部着丝粒染色体的种类为原始类群(NF=48),而具有较多中部或亚中部着丝粒染色体的是特化类群(NF > 48),即染色体臂数多的类群比染色体臂数少的类群更为特化。棕点石斑鱼的染色体相对长度从(3.02±0.09)%–(5.31±0.09)%,相差不大,收敛性强,端部着丝粒染色体有46条,臂数50,符合上述条件,应属于高位类群中的特化类群(廖经球等, 2006)。鞍带石斑鱼(2n=4st+44t,NF=50)的NF > 48(王德祥等, 2003),应属于特化类群。本研究表明,珍珠龙胆染色体的相对长度从(2.71±0.09)%–(5.58±0.22)%,相差不大,收敛性强,端部着丝粒染色体有44条,臂数52。因此,珍珠龙胆也属典型高位类群鱼类中的特化类群。
石斑鱼属的种类繁多,某些物种在形态上极为相似,而实际上是存在生殖隔离的不同群体(李锡强等, 1994)。在自然状况下,石斑鱼属许多种类在种间存在一定程度的杂交,目前,有关其杂交后代的存活率、可育性研究较少。珍珠龙胆杂交优势明显,是一种已取得很大成功的杂交新种。通过核型可知鞍带石斑鱼与棕点石斑鱼同属于特化类群,根据鱼类杂交育种中核型越相近,杂交越能成功的原则(王祖熊等, 1986),鞍带石斑鱼与同属于特化类群的棕点石斑鱼杂交能够获得杂交新种也证实了其杂交的可行性。
| 丁少雄, 王世锋, 王德祥, 等. 斜带石斑鱼染色体核型分析. 厦门大学学报(自然科学版) , 2004, 43 (3) : 426-428 | |
| 小岛吉雄. 水产生物及遗传育种. 东京: 水交出版社, 1979 : 46 -62. | |
| 王小丽, 郑元升, 戴云, 等. 巨石斑鱼染色体核型分析. 水利渔业 , 2008, 28 (3) : 62-63 | |
| 王云新, 王宏东, 张海发, 等. 斜带石斑鱼与赤点石斑鱼的核型研究. 湛江海洋大学学报 , 2004, 24 (3) : 4-8 | |
| 王世锋, 王德祥, 苏永全, 等. 双棘黄姑鱼染色体组型分析. 厦门大学学报(自然科学版) , 2003, 42 (5) : 682-684 | |
| 王梅林, 郑家声, 朱丽岩, 等. 我国海洋鱼类和贝类染色体组型研究进展. 青岛海洋大学学报(自然科学版) , 2000, 30 (2) : 277-284 | |
| 王琼, 童裳亮. 贻贝核型及染色体带型分析. 动物学报 , 1994, 40 (3) : 309-316 | |
| 王德祥, 苏永全, 王世锋, 等. 宽额鲈染色体核型研究及制作方法的比较. 台湾海峡 , 2003, 22 (4) : 465-468 | |
| 王祖熊, 张锦霞, 靳光琴. 鱼类杂交不亲和性的研究. 水生生物学报 , 1986, 10 (2) : 171-179 | |
| 毛连菊, 李雅娟. 5种海水鱼类染色体的组型分析. 大连水产学院学报 , 2002, 17 (2) : 108-113 | |
| 成庆泰, 郑葆珊. . 中国鱼类系统检索 , 1987 : 47-50 | |
| 李样红, 韩巍, 彭树锋, 等. 珍珠龙胆高位池养殖技术研究. 科学养鱼 , 2013 (2) : 41-42 | |
| 李树深. 鱼类细胞分类学. 生物科学动态 , 1981, 2 : 8-15 | |
| 李锡强, 彭跃东. 斑带石斑鱼和黑边石斑鱼核型的研究. 湛江水产学院学报 , 1994, 14 (2) : 22-26 | |
| 余先觉, 周暾, 李渝成, 等. . 中国淡水鱼类染色体 , 1989 : 179 | |
| 张海发, 王云新, 刘付永忠, 等. 鞍带石斑鱼人工繁育及胚胎发育研究. 广东海洋大学学报 , 2008, 28 (4) : 36-40 | |
| 张伟明, 吴萍, 吴康, 等. 两种鱼类染色体制片方法的比较研究. 水利渔业 , 2003, 23 (5) : 9-10 | |
| 吴彪, 杨爱国, 周丽青, 等. 几种鱼类染色体制备方法的比较. 安徽农业科学 , 2012, 40 (12) : 7168-7170 | |
| 邹记兴, 余其兴, 周菲. 点带石斑鱼的核型、C带、Ag-NORs. 水产学报 , 2005, 29 (1) : 33-37 | |
| 陈毅恒, 容寿柏, 刘绍琼. 鲑点石斑鱼的核型. 福建水产 , 1990b (1) : 23-25 | |
| 陈毅恒, 容寿柏, 刘绍琼, 等. 六带石斑鱼(Epinephelus sexfasciatus)的核型分析. 湛江水产学院学报 , 1990a, 10 (1) : 43-44 | |
| 林义浩. 快速获得大量鱼类肾细胞中期分裂相的PHA体内注射法. 水产学报 , 1982, 6 (3) : 201-208 | |
| 周丽青, 杨爱国, 柳学周, 等. 半滑舌鳎染色体核型分析. 水产学报 , 2005, 29 (3) : 417-419 | |
| 周翰林, 张勇, 齐鑫, 等. 两种杂交石斑鱼子一代杂种优势的微卫星标记分析. 水产学报 , 2012, 36 (2) : 161-169 | |
| 郑莲, 刘楚吾, 李长玲. 4种石斑鱼染色体核型研究. 海洋科学 , 2005, 29 (4) : 51-55 | |
| 郭丰, 王军, 苏永全, 等. 云纹石斑鱼染色体核型研究. 海洋科学 , 2006, 30 (8) : 1-3 | |
| 施立明. . 遗传多样性及保护 , 1996 : 73-82 | |
| 洪满贤, 杨俊慧. 青石斑鱼染色体组型的研究. 厦门大学学报(自然科学版) , 1988, 27 (6) : 714-715 | |
| 赵金良. 我国海水鱼和咸淡水鱼染色体组型研究概述. 上海水产大学学报 , 2000, 9 (4) : 344-347 | |
| 钟声平, 陈超, 王军, 等. 七带石斑鱼染色体核型研究. 中国水产科学 , 2010, 17 (1) : 150-155 | |
| 贾志良, 李智盈, 包振民, 等. 增加贝类染色体分裂相的方法初探. 青岛海洋大学学报(自然科学版) , 2001, 31 (2) : 232-236 | |
| 舒琥, 魏秋兰, 罗丽娟, 等. 广东沿海4种石斑鱼的染色体组型分析. 广东农业科学 , 2012, 39 (8) : 124-127 | |
| 楼允东. 中国鱼类染色体组型研究的进展. 水产学报 , 1997, 21 (S1) : 82-96 | |
| 谭杰, 孙慧玲, 高菲, 等. 刺参染色体制备的初步研究. 海洋科学 , 2011, 35 (3) : 8-11 | |
| 廖经球, 尹绍武, 陈国华, 等. 褐点石斑鱼的核型研究. 水产科学 , 2006, 25 (11) : 567-569 | |
| Aguilar CT, Galetti PM. Chromosomal studies in South Atlantic serranids (Pisces, Perciformes). Cytobios , 1997, 89 (357) : 105-114 | |
| Alvarez MC, Thode G, Cano J. Somatic karyotypes of two Mediterranean teleost species: Phycis phycis (Gadidae) and Epinephelus alexandrines (Serranidae). Cytobios , 1983, 38 (150) : 91-95 | |
| Heemstra PC, Randall JE. Groupers of the World. FAO Fisheries Synopsis , 1993, 16 (125) : 130-132 | |
| Levan A, Fredga K, Sandberg AA. Nomenclature for centromric position on chromosomes. Hereditas , 1964, 52 (2) : 201-220 | |
| Martínez-Rodríguez G, Thode G, lvarez MDC, et al. C-banding and Ag-NOR reveal heterogeneity among karyotypes of Serranids (Perciformes). Cytobios , 1989, 58 (232) : 53-60 | |
| Medrano L, Bernardi G, Couturier J, et al. Chromosome banding and genome compartmentalization in fishes. Chromosoma , 1988, 96 (2) : 178-183 DOI:10.1007/BF00331050 | |
| Molina WF, Maia-Lima FA, Affonso PRAM. Divergence between karyotypical pattern and speciation events in serranidae fish(Perciformes). Caryologia , 2002, 55 (4) : 299-305 DOI:10.1080/00087114.2002.10797880 | |
| Natarajan R, Subrahmanyam K. A karyotype study of some teleost from Portonovo waters. P Indian AS-Math Sci , 1974, 79 (5) : 173-196 | |
| Ojima Y, Hitosumachi S, Makino S. Cytogenetic studies in lower vertebrates I. A. preliminary report on the chromosomes of the Funa (Carassius auratus) and the goldfish (a revised study). Proc Japan Acad , 1966, 24 : 62-66 | |
| Rivlin K, Rachlin JW, Dale G. A simple method for the preparation of fish chromosomes applicable to field work, teaching and banding. J Fish Biol , 1985, 26 (3) : 267-272 DOI:10.1111/jfb.1985.26.issue-3 | |
| Rodríguez-Daga R, Amores A, Thode G. Karyotype and nucleolus organizer regiones in Epinephelus Caninus (Pisces, Serranidae). Caryologia , 1993, 46 (1) : 71-76 DOI:10.1080/00087114.1993.10797248 | |
| Ruiz-Carus R. Chromosome Analysis of the Sexual Phases of the Protogynous Hermaphrodites Epinephelus guttatus and Thalassoma bifasciatum (Serranidae and Labridae; Teleostei). Caribb J Sci , 2002, 38 (1-2) : 44-51 |



